转自:药明康德
在探索癌症发生机制时,许多研究会关注哪些基因变化导致了细胞的异常增殖,常见的可能性有抑癌基因的失活,比如控制细胞周期的TP53基因突变会使得细胞分裂失控,又或者原癌基因过度激活,比如KRAS基因突变后会增加细胞复制和生长活性。这两种情况都可能使细胞发生癌变,促进肿瘤发生。
不过,科学家在描述这些基因影响的时候,通常针对的都是基因的编码区,也就是基因上能通过转录、翻译等过程合成蛋白的区域。而非编码区更像是一个隐形的角色,鲜有研究关注它们的功能,甚至有人认为该区域的突变对基因表达影响不大。因此也被有些研究者称作基因上的“暗物质”。

图片来源:123RF
近期,来自加利福尼亚大学洛杉矶分校的团队打破了我们对非编码区的认知,他们发现该区域的DNA不编码功能蛋白,却非常积极地参与着蛋白的mRNA水平调控,这也决定着抑癌或促癌蛋白的最终表达水平高低。而非编码区的一些突变会导致产生异常数量的mRNA,并且与癌症发生风险有关,相关研究已经发表在《自然-通讯》上。
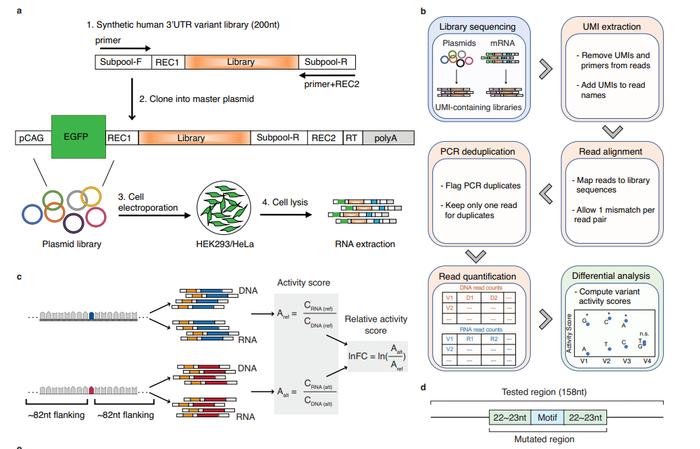
新研究重点关注了3端非翻译区(3’UTR),它是基因调控的关键枢纽,会影响诸如RNA稳定性、RNA定位和翻译等方面。绝大多数发生在3’UTR的突变都属于罕见突变,并且不同个体之间还具有独特的突变位点,因此研究起来会极具挑战性。
为此,作者综合了用于研究编码基因的多种方法,构建出了一个专用于分析3’UTR的突变筛选系统,他们在两个细胞系中共测试了超过1.7万个罕见突变的作用,结果他们发现那些确认存在功能性的3’UTR的罕见突变中,有70%处于癌症相关基因上。
随后,他们单独将这部分突变筛选出来,并与166个癌基因进行了匹配,他们进一步测试了当这些突变发生时癌基因会发生哪些变化。结果显示,测试中有33%的突变可以改变155个癌基因的mRNA水平。
过去的研究已经知道,3’UTR可以招募一些反式调节因子,比如miRNA来完成转录后的调节工作。从机制上来说,当产生这些罕见突变时,miRNA的结合位点会被改变,因此影响了基因转录后的调节过程。作者发现,在健康或者癌细胞系中,都有超过63%的罕见突变位点与miRNA结合位点重叠。
尽管非编码区的突变常被认为影响不大,但新研究却意外发现,3’UTR的突变发生率高与肺鳞癌患者的无进展生存期更短具有显著联系。此外,作者还发现头颈鳞癌的总生存率也与非编码区的突变有关。
作者指出,这些发现表明非编码区的功能性突变数量可以用于预测特定癌症患者的生存情况,这也可能为新型的癌症诊断工具研发带来思路。研究团队在未来想更精细地研究这些罕见突变的调节机制,从过往忽略的角度来解开癌症发生的谜团。
参考资料:
[1] Fu, T., Amoah, K., Chan, T.W. et al. Massively parallel screen uncovers many rare 3′ UTR variants regulating mRNA abundance of cancer driver genes. Nat Commun 15, 3335 (2024). https://doi.org/10.1038/s41467-024-46795-7