转自:诺唯赞生物
qPCR实验作为常见的分子检测手段已经被广泛使用,但小小的qPCR实验却有大大的学问,一个细节的不小心都有可能导致实验的失败!
今天要和大家分享的实验细节是关于qPCR实验中模板的投入问题,那大家在平时是如何判断cDNA稀释倍数呢?又是怎么计算cDNA的加入体积呢?是否了解投模板时怎么做才能减少误差和错加漏加呢?带着这些疑问让我们一起来了解一下qPCR模板投入的基本操作吧!
1. 如何确定cDNA的稀释梯度及投入量
方法一
将cDNA做梯度稀释,把得到的不同梯度cDNA同时进行qPCR,选择位于15-33范围内的CT值对应的cDNA稀释梯度作为最佳稀释梯度。如下图所示。(经验值认为,目的基因CT值建议在15-33内,内参CT值建议在15-25内)
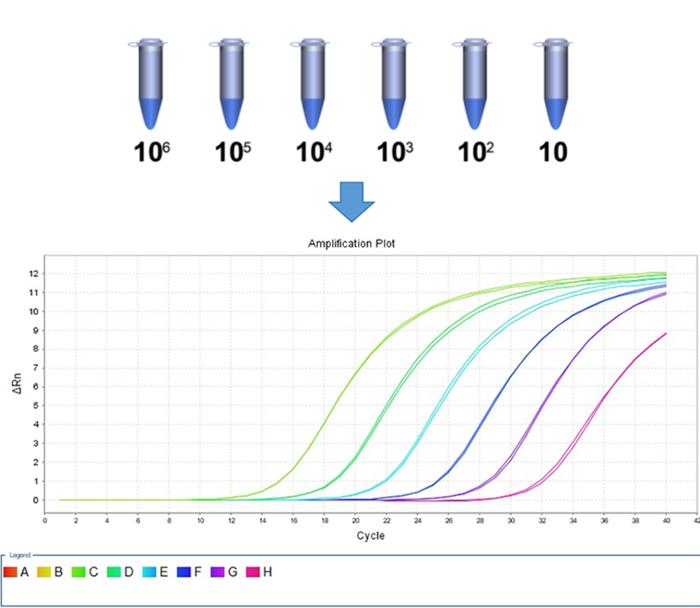
举个例子:
如要扩增某处理组 GAPDH 内参基因,将逆转得到的cDNA进行10倍梯度稀释,得到的cDNA浓度梯度分别为:100(原液)、10-1、10-2、10-3、10-4,将5个cDNA模板同时上机做qPCR,得到的CT值分别为:13、16.3、19.6、22.9,26.2。所以后续再扩增该处理组 GAPDH,就可以选择10-1、10-2、10-3梯度进行扩增。
方法二
若拿到一个之前没有做过的体系,不知道其拷贝数高低时,可以先选择cDNA原液进行qPCR并得到CT值。根据2△CT=浓度差公式可知,模板每稀释10倍,则CT值扩大3.3个循环左右,可以按照此规律大致判断CT值大小,调整最佳cDNA稀释倍数。
举个例子:
某处理组 GAPDH 内参基因,cDNA原液上样1 μl,得到的CT值为10。要想使该处理组 GAPDH 内参基因的CT值为16左右,仅需在cDNA原液的基础上稀释100倍即可使该处理组 GAPDH 内参基因的CT值达到16左右。
注意:
✦不同的体系(基因)、同一基因不同的处理组都需要进行最佳cDNA稀释梯度的验证,保证所有的体系的CT值都落在15-33范围内,可以有效避免因cDNA稀释梯度不准确导致CT值过小或过大,甚至无CT值的情况。
✦cDNA原液的添加体积不能超出qPCR反应体系的1/10,如20 μl qPCR反应体系,cDNA原液最多只能上2 μl,超出1/10体系,会对qPCR反应产生抑制作用。
2. 如何避免投模板时误差和错加漏加
一、采取大体积配制试剂,预混Mix溶液,避免小体积加样误差导致各反应孔反应成分不均;
二、使用有颜色的逆转录和定量试剂,可以起到移液可视化的作用,防止样本太多导致的错加漏加。
举个例子:
实验体系配制(以Vazyme #Q312推荐加样体系为例,检测1个内参基因、1个目的基因,2组样本包括对照组和处理组):
Mix 1:qPCR Mix + 引物(共9孔)
Mix 2:水 + cDNA模板(共6孔)
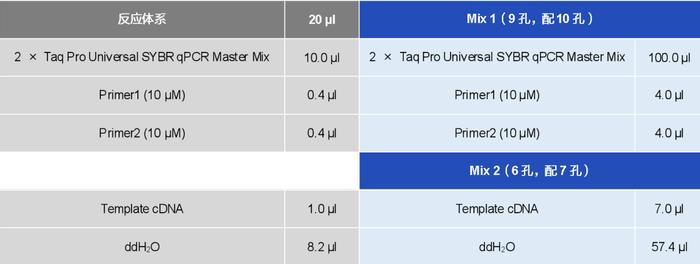
注:①一般会多配一些样品,这样保证最后每个孔都能有同等体积的液体;预混后要涡旋离心,使其混匀!
② Q312为通用型试剂,无需在不同仪器上调整ROX的浓度。若所用试剂为非ROX预混型试剂,且仪器需要ROX进行校正(如ABI stepone),需要在加样时注意添加ROX。
加样效果展示:
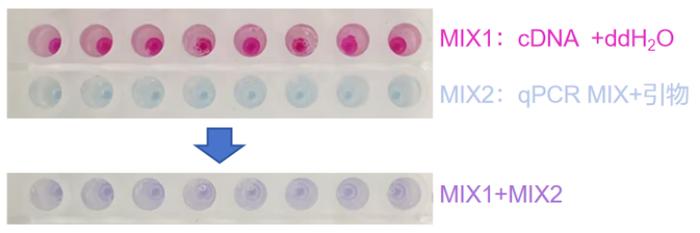
注:图为cDNA原液的加样效果,若cDNA进行了稀释,颜色可能会变浅。
如果您有任何疑问,欢迎联系您身边的诺唯赞人,我们将持续为您提供更优质的产品与服务!如果您有任何需求都可致电:400-600-9335!


