转自:药学进展

孙春萌

教授,博士生导师。现任中国药科大学药学院药剂系主任,校团委兼职副书记,国家药监局药物制剂及辅料研究与评价重点实验室副主任;先后入选江苏省“六大人才高峰”高层次人才(2016),江苏省第六批“333 高层次人才培养工程”(2022)。长期从事药物递送技术和药用辅料研究,先后主持国家药品标准提高计划、国家自然科学基金等各类科研课题 15 项;作为主要完成人或指导教师,荣获联合国开发计划署第三届“青年创客挑战赛”一等奖等省级以上奖励 7 项;参编《中国药典》等专著4 部;以第一作者或通信作者在 Nature Communications,Journal of Controlled Release 等国内外高水平期刊发表 SCI 论文 40 余篇。
骨靶向药物递送系统研究进展 PPS
张铭笑 , 孙春萌 *
(中国药科大学药学院药剂系,中国药科大学药用辅料及仿创药物研发评价中心,国家药品监督管理局药物制剂及辅料研究与评价重点实验室,江苏 南京 210009)
【摘要】骨骼是人体重要的组成部分,随着人口老龄化以及肿瘤高发,骨相关疾病已经严重影响患者的生活质量。全身给药治疗骨类相关疾病存在靶向性差、副作用大、药物利用度低等缺点。骨靶向递药系统有效克服了传统给药方式治疗骨类相关疾病的缺陷,利用骨靶向基团对药物载体进行功能化修饰可有效提高药物疗效,降低成本,并减少不良反应。综述通过查阅相关文献,对近几年骨靶向系统的研究进展进行了归纳总结,介绍了骨靶向系统中骨靶向基团与纳米载体的应用,为骨靶向药物递送系统的深入研究开拓了新的思路。
骨骼是人体重要的组成部分,由骨膜、骨质及骨髓构成,在体内具有支持保护其他器官、储存矿物质、调节激素等作用。随着人口老龄化加重,骨类疾病治疗药物需求增大。目前,骨类疾病主要通过全身给药进行治疗 [1],然而由于骨组织自身血供少且药物渗透性差,一般给药途径很难使药物到达病灶部位,所以常增加剂量以维持骨组织中有效药物浓度,对病人其他组织或器官造成了不必要的毒性和副作用。1986 年,Pierce 首次提出“骨靶向”的概念,即化合物若能够沉积于骨组织并能与羟基磷灰石(hydroxyapatite,HAP)亲和则具有“骨靶向”能力。骨靶向药物递送系统由骨靶向基团以及药物载体组成,药物通过粘附或包裹于载体的方式进入机体并且在体内释放,可将药物选择性递送至骨组织,从而提高生物利用度,降低用药剂量与频率,减少毒性和副作用 [2-3]。本文通过查阅相关资料介绍了骨靶向药物递送系统的最新进展,总结了目前研究中的骨靶向基团以及骨靶向纳米载体,以期对骨类疾病的靶向治疗提供一定的参考价值。
1
骨靶向基团
用于修饰骨靶向药物递送系统的骨靶向基团需要具备以下 3 个特性:1)对骨组织亲和;2)具有良好的生物相容性与低毒性;3)不影响负载药物的稳定性和疗效。骨靶向基团有多种类型,表 1 概括总结了各类型的骨靶向基团特点 [4-7]。

1.1 双膦酸盐
双膦酸盐(bisphosphonates,BPs)是一种人工合成的焦磷酸盐类似物,能特异性与骨质中的 HAP结合,具有显著抑制骨吸收和增加骨量的作用 [8]。BPs 的基本结构由 2 个膦酸基团和 1 个中心碳原子构成,以 P—C—P 基团取代具有抑制异位钙化作用的天然焦磷酸盐的 P—O—P 基团(见图 1)后,不仅能够有效抵抗酶的降解作用,同时可以改变其生物学及药动学性质,增加稳定性 [9]。
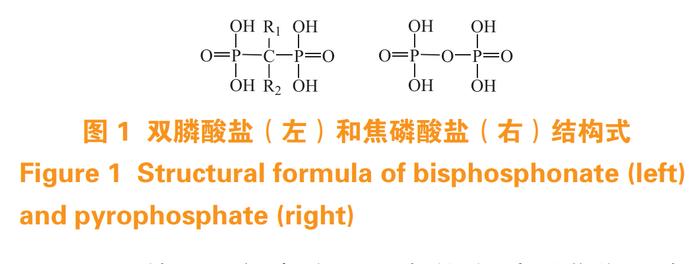
BPs 利用 2 个膦酸基团中的去质子化羟基与HAP 上 Ca2+ 螯合实现对骨的靶向 [10]。Jing 等 [11]将聚乳酸-羟基乙酸共聚物 [poly(lactic-co-glycolic acid),PLGA]、β-环糊精修饰的壳聚糖和阿仑膦酸修饰的海藻酸通过离子凝胶法制备了阿仑膦酸纳米载体用于骨靶向递送,体外试验结果显示修饰后的阿仑膦酸纳米载体能成功靶向骨组织,具有良好的细胞相容性和血液相容性。Sun 等 [12] 以唑来膦酸修饰的介孔二氧化硅为载体制备了用于光热疗法的纳米粒,在近红外光照射下,该载体具有良好的骨靶向能力和抑制破骨细胞分化能力。
1.2 四环素类
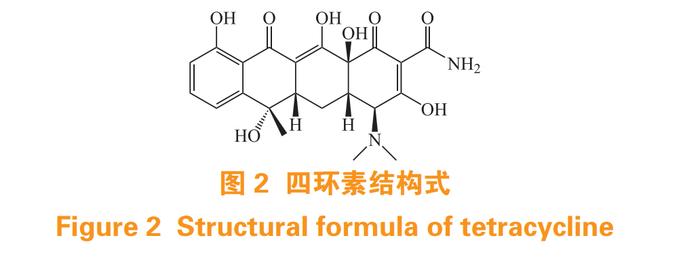
四环素(tetracycline,TC)(见图 2)是由放线菌产生的一类广谱抗生素,对革兰阳性菌、革兰阴性菌、立克次体等具有良好的抑制作用。研究发现,四环素对于骨组织有特异性选择作用,可沉积于骨组织中并与 HAP 上 Ca2+ 络合,可作为递送药物到骨组织的靶向基团 [13]。另外,四环素结构中的羟基与 HAP 之间的范德华力和氢键也可增加其对骨组织的亲和作用 [14]。邹萍等 [15] 将 TC 和 PLGA 通过酰胺键、共价键连接在聚乙二醇(polyethylene glycol,PEG)两端羧基上,使其在水中通过自组装形成胶束 TC-PEG-PLGA;采用异硫氢基荧光素标记装载游离模型药物阿托伐他汀的 TC-PEG-PLGA 并研究其体外骨组织靶向能力。体外试验结果显示,相较于不含 TC 的 PEG-PLGA 胶 束,TC-PEG-PLGA 对于 HAP 亲和能力提高了近 4.73 倍。Wang 等 [16] 以PLGA 和 TC 为骨靶向分子,采用溶剂乳化法制备了载辛伐他汀的纳米颗粒用于治疗去卵巢大鼠骨质疏松症。体内外试验结果显示,该纳米粒具有良好的骨组织靶向能力。
1.3 多肽类
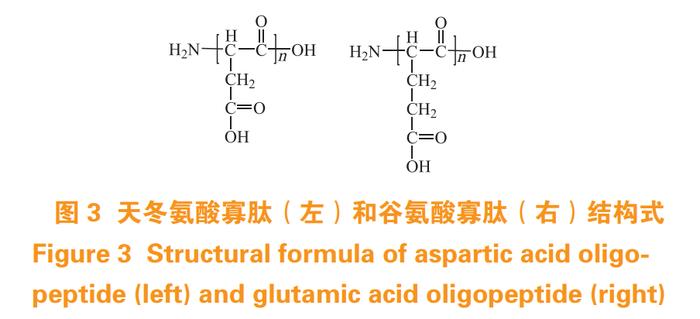
多肽是常见的天然聚合物,由多个氨基酸组成,具有代谢快、免疫原性低、毒性和副作用小等优点。多年来,随着对骨基质蛋白的广泛研究,发现骨钙素、牙本质基质蛋白、骨桥蛋白、胎球蛋白等均具有与骨矿物表面 Ca 2+ 螯合的能力,其中寡肽中的天冬氨酸寡肽 (Asp) n 与谷氨酸寡肽 (Glu) n 对 HAP 亲和力较高 [17]。研究显示,骨靶向肽与 HAP 的结合能力主要取决于氨基酸的数目,且氨基酸寡肽数目为 6 ~ 10 个时骨靶向效果最佳,具体数目需根据药物分子的大小决定。另外,多肽的 L 或 D 型光学异构体在一定程度上影响其体内生物相容性,与 L 型相比,D 型多肽不易被免疫系统识别,因此具有更好的生物相容性 [18]。据报道,具有 4 ~ 10 个天冬氨酸或谷氨酸单位的酸性寡肽(Asp4-10,Glu4-10)(见图 3)被认为是生物相容性较好的骨靶向肽,二者骨亲和力相当,且与旋光异构体类型无关 [3]。另外具有 6 个天冬氨酸、丝氨酸和丝氨酸重复序列的(AspSerSer)6 也表现出良好骨靶向性能 [18]。
1.4 生长因子类
生长因子(growth factor,GF)是一类在组织修复和再生过程中可调节关键细胞活动的天然生物介质,可通过诱导骨细胞、参与骨形成细胞的生长和增殖来促进骨再生 [19]。有关骨形成的 GF 主要包括血小板源生长因子(platelet derived growth factor,PDGF)、 骨 形 态 发 生 蛋 白(bone morphogenetic proteins,BMPs)、 转 化 生 长 因 子 β(transforming growth factor β,TGF-β)、 类 胰 岛 素 样 生 长 因 子(insulin-like growth factor,IGF)等。骨细胞具有此类生长因子相关受体,因此生长因子类化合物具有优良的趋骨性 [20]。王军等 [21] 经研究证明包载有TGF-β 的微泡可以靶向大鼠受损骨骼肌并刺激其再生。唐越 [22] 利用超顺磁性壳聚糖纳米粒递送胰岛素样生长因子结合蛋白 5,在磁场辅助作用下采用磁转染系统治疗骨肉瘤的肺转移。结果显示,该纳米粒生物安全性良好,可成功靶向治疗骨肉瘤肺转移。
1.5 其他
除以上基团外,大黄蒽醌类、聚丙二酸类化合物等也可作为骨靶向基团。大黄蒽醌类化学结构与四环素相似,可与 HAP 形成螯合物,因此也具有良好的亲骨性。聚丙二酸与骨钙素空间构象相近,其原子间距与 HAP 晶体表面的 Ca2+ 和 PO43+ 原子间距一致,因此可直接与 HAP 结合。研究显示小分子杂环类也具有骨靶向性。Willson 等 [23] 发现分子结构中存在潜在酰氨基的邻位羟基杂环羧酸与 HAP 具有良好的亲和性,因此选用 3-羟基-4 吡唑羧酸为载体,利用吡唑环 1 位氮原子与己烯雌酚类似物偶联,成功制备了具有骨靶向能力的化合物,这些化合物既能与 HAP 结合,又保留了弱雌激素活性。另外,如25 ~ 35 碱基长度单链 RNA 或 DNA 核苷酸序列也具有亲骨性 [24]。
2
骨靶向药物递送系统纳米载体
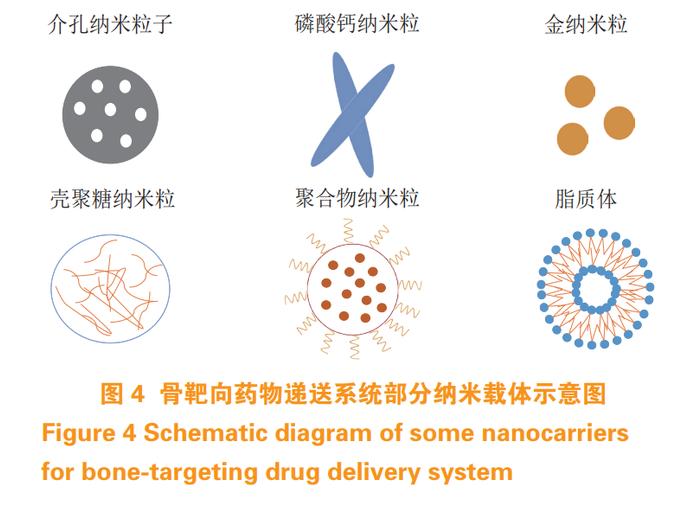
近年来,纳米技术领域不断进步,纳米载体逐渐成为骨靶向递药系统中又一重要组成部分。由于组织和器官主要依靠细胞与纳米尺度的细胞外基质相互作用形成,因此纳米载体在治疗骨病方面具有独特的优势。利用被骨靶向基团修饰的纳米颗粒来负载药物,不仅赋予了药物靶向性,而且改善了药物的溶解度,保护药物免受酶促降解,延长药物在体内循环时间,降低药物毒性和副作用,并使药物以可控的速率进行释放。图 4 为骨靶向药物递送系统部分纳米载体示意图。
2.1 无机纳米粒
2.1.1 二氧化硅纳米粒 硅是生物矿化机制中重要的微量元素,在骨骼生长和钙化过程中具有重要作用。二氧化硅是天然无毒的非金属材料,但因密度大、比表面积小而在应用中受到限制。介孔材料的出现解决了上述难题,这类材料具有大小可控的孔隙结构、比表面积大、吸附性强等优势。介孔二氧化硅纳米粒(mesoporous silica nanoparticles,MSNs)作为骨重建研究中的高效载体,应用前景广泛。MSNs 可装载抗骨质疏松药物和 BMP2 等骨病治疗药物,在缓释作用下药物通过诱导成骨细胞分化、促进钙沉积、增加骨组织相关蛋白的表达来促进骨再生。黄酮类化合物淫羊藿苷(icariin,ICA)在预防骨质疏松方面具有重要作用。陈莹 [25] 以多级孔二氧化硅微球(multi-stage porous silica microspheres,MPSMs)为载体负载 ICA,研究结果显示,负载ICA 的 MPSMs 可成功促进 MC3T3-E1 细胞(来源于小鼠颅骨胚胎前成骨细胞,可在体外分化为成骨细胞)的增殖、迁移和分化,负载性能较好。
2.1.2 磷酸钙纳米粒 磷酸钙纳米粒(calcium phosphate nanoparticles,CPNs)是由钙离子与磷酸根离子以不同比例结合而成的纳米颗粒。对于不同钙/磷比和晶相的磷酸钙晶体,磷酸氢钙和磷酸二氢钙溶解度较高,会在体液环境中迅速溶解而导致局部钙磷离子浓度过高,从而产生明显的细胞毒性;而 HAP 和双相磷酸钙等溶解度较小的 CPNs 具有更好的生物相容性。CPNs 通过氢键或静电吸引作用与药物分子结合,自身已表现出一定的促进成骨能力,负载双膦酸盐、生长因子、抗生素等后可在骨损伤区域长期缓释药物,具有更好的促成骨效果 [26]。Wang 等 [27]将 BMP2 负载于双相磷酸钙纳米颗粒用于治疗大鼠颅骨缺损,该 CPNs 表现出优良的成骨效果,可持续释放 35 天,另外 BMP2 可提高双相磷酸钙的降解效率,且可有效增强其生物相容性。Zhang 等 [28]开发了由阿仑膦酸修饰,负载多西他赛和音猥因子(Sonic hedgehog,SHH)siRNA 的骨靶向磷酸钙脂质杂化纳米颗粒,用于治疗前列腺癌骨转移,体内外研究显示该纳米颗粒具有良好的骨靶向能力,可有效杀伤癌细胞,并利用脂类修饰有效增加 CPNs胶体的稳定性。
2.1.3 金纳米粒 金纳米粒(gold nanoparticles,AuNPs)是金的缔合胶体,尺寸一般介于 1 ~ 100 nm,对骨相关细胞如破骨细胞、成骨细胞、间充质干细胞等有重要调节作用。AuNPs 易合成、表面易修饰以及化学性质稳定,可通过渗透作用或内吞作用进入细胞,因此常作为基因递送的载体。目前有 2 种方式将基因连接到 AuNPs:其一是将基因用含巯基的活性基团修饰后通过 Au—S 键将基因与 AuNPs 连接;其二是用带正电荷的基团修饰 AuNPs 后,将带负电的基因与带正电的 AuNPs 通过静电作用连接。杨雪华 [29] 通过静电吸附作用将 microRNA-140 连接到AuNPs 上成功制备了载 microRNA-140 的金纳米粒复合物用于治疗关节炎。MicroRNA-140 是非编码RNA,可通过调节与骨相关基因的表达来促进软骨修复,但因难以进入细胞且易被核酸酶降解,因此采用 AuNPs 递送以提高其稳定性。研究结果显示,AuNPs可将microRNA-140高效递送至软骨细胞内,且能上调细胞内 microRNA-140 的表达。
2.2 有机纳米粒
2.2.1 壳聚糖纳米粒 壳聚糖(chitosan,CS)是自然界来源丰富的天然阳离子聚合物,具有优良的生物相容性和生物降解性,在生物医药领域应用广泛。目前 CS 纳米粒的制备方法主要包括离子交联法、共价交联法、自组装法、复合凝聚法和喷雾干燥法等 [30]。李永恒等 [31] 制备了负载阿霉素的 CS 纳米颗粒,通过体内外试验证明合成的载药纳米颗粒增强了阿霉素的药效和稳定性,减少了药物的不良反应,实现了化疗药物向骨肉瘤细胞的被动靶向递送。
CS纳米粒也常作为基因载体。从化学结构来看,带正电的 CS 阳离子聚胺可以与带负电的核苷酸通过静电作用结合,以保护 CS 纳米粒不被核酸酶降解。然而由于未改性的 CS 纳米粒靶向性与水溶性具有一定的局限性,因此在作为有效的基因治疗载体使用之前必须经过化学修饰。为了实现这一目标,Zhao 等 [32] 利用聚乙烯亚胺(polyethyleneimine,PEI)修饰 CS 纳米粒,以改善人 BMP2(hBMP2)基因的传递。PEI 是一种高效的基因载体,可以通过质子海绵效应高渗破裂以避免被溶酶体降解,但由于其细胞毒性在应用中存在局限性,因此 Zhao 等将 CS 与 PEI 的比例确定为 20 : 1,以同时发挥 CS的低细胞毒性与 PEI 可提高转染效率的优点。体内试验结果表明,在大鼠骨缺损模型中,植入 CS-PEI/hBMP2 12 周后显著促进骨形成。另外,CS 纳米粒还可以用硫酸盐基团进行修饰,生成与肝素结构相似的多糖,可与 BMP2 的碱性氨基酸链结合,以改善 BMP2 的包封率和缓释能力,提高其在骨修复中的生物活性。Cao 等 [33] 设计了包含 2-N 和 6-O 硫酸化 CS 纳米粒的光交联水凝胶用于 BMP2 的传递,以维持 BMP2 的长期释放,避免无效释放导致的慢性炎症和骨异位化。结果显示,硫酸盐基团修饰的CS 纳米粒可保证 BMP2 在体内持续释放 42 天以上,且 2 周内新骨显著增加。
2.2.2 聚合物纳米粒 聚合物纳米粒(polymer nano[1]particles,PNPs),由具有生物相容性与生物可降解性的聚合物制备而成。聚合物包括海藻酸盐、蛋白质、纤维素等天然聚合物以及由相对分子质量较大的单体或单体单元组成的合成聚合物。白少柏 [34] 以聚酰胺-胺树状聚合物(polyamidoamine dendrimer,PAMAM)为载体,阿仑膦酸钠作为骨靶向配体,成功制备出聚合物纳米粒 DTX@ALN-PAMAM 和DTX@ALN-HA-PAMAM,研究显示 2 种纳米粒均具有良好的骨靶向性。Jing 等 [11] 利用 PLGA 和 β 环糊精修饰的CS制备了阿仑膦酸钠聚合物纳米颗粒,该纳米颗粒具有良好的细胞相容性,与 HAP 高度亲和,可作为治疗骨质疏松症的骨靶向载体。
PLGA 是由乳酸和羟基乙酸共聚合而成的聚合物,在体内水解为单体酸、乳酸和羟基乙酸,最终由三羧酸循环转变为二氧化碳和水,因此 PLGA 对人体无毒无刺激性,是应用最成功的多聚物之一 [35]。尽管 PLGA 具有优良的生物相容性和生物可降解性,但单纯的 PLGA 作为骨靶向载体时,其本身的物理化学性质会降低药物效能。首先,PLGA 具有疏水性,具有疏水性表面的纳米粒易被网状内皮系统(reticuloendothelial system,RES)识别为异物而被肝脾清除。PEG 亲水性较好,经 PEG 修饰后的 PLGA 纳米粒表面具有大量的亲水性羟基,可避免被 RES 吞噬,使纳米粒在血液循环中停留更长时间,有利于负载药物的 PLGA 纳米粒透过骨髓-血液屏障到达骨组织发挥作用。刘永伟 [36] 将雌激素负载于 PEG-PLGA 纳米粒中,利用阿仑膦酸钠对纳米载体进行骨靶向修饰,从而构建了可避免 RES 吞噬的骨靶向载药纳米粒,经体内外试验证明载药纳米粒对大鼠的骨质疏松症具有良好的治疗效果。其次,PLGA 纳米载体表面电势较低,不利于 DNA 和质粒等带负电的药物吸附,通过阳离子的修饰可以改善PLGA 纳米粒表面电势。PEI 是最常见的用于 PLGA修饰的阳离子,通过共价偶联或表面吸附与 PLGA结合,从而形成包埋能力更强的聚合物纳米载体 [37]。
2.2.3 脂质纳米粒 脂质纳米粒(lipid nanoparticles,LNPs)是由固态和液态脂质组成的纳米载体,药物或其他活性物质可通过包裹于脂质核或吸附于其表面构成新型载药系统。LNPs 包括脂质体(liposomes)、固体脂质纳米粒(solid lipid nanoparticles,SLNs)、纳米结构脂质载体(nanostructured lipid carriers,NLCs)、脂质-药物共轭物(lipid drug conjugate,LDC)等,其中脂质体应用最为广泛,是由磷脂双层膜结构和中心水核组成的磷脂囊泡,具有良好的生物降解性和生物安全性,可使两亲性药物在人体血液循环中长期缓慢地释放,降低药物毒性和副作用。脂质体经过修饰后可通过被动靶向、主动靶向及双重靶向的方式负载药物沉积于骨组织中。其中主动骨靶向脂质体应用最多,即对脂质体表面进行化学修饰使之具有骨靶向性,脂质体中部分阴离子磷脂类作为凋亡细胞的标志可与巨噬细胞上特定受体结合从而被巨噬细胞吞噬,利用此特点可实现经修饰的脂质体对骨髓巨噬细胞的主动靶向,以防止被肝等巨噬细胞摄取 [38]。Huang 等 [39] 利用 Asp8 肽修饰的脂质体负载 ICA,研究结果显示该脂质体骨靶向性能良好。
3
总结与展望
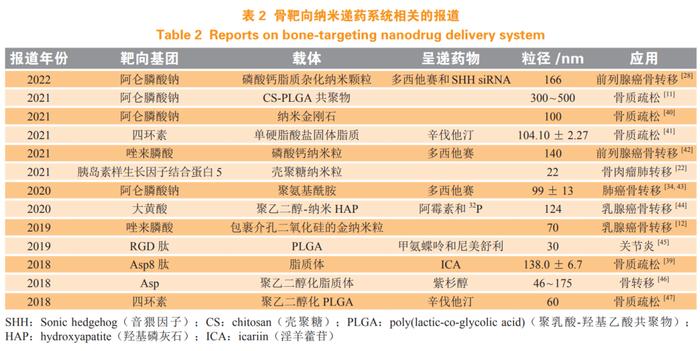
目前骨靶向药物递送系统已经在各类骨相关疾病领域得到广泛的研究,表 2 列举了近几年关于骨靶向药物递送系统的相关报道。骨靶向药物递送系统将药物选择性递送至骨环境中,具有提高药物的生物利用度、降低毒性和副作用等优点。然而纳米载体在临床应用中发挥优势的同时也带来了许多挑战,例如药物负载能力不足、药物递送效率低、药物释放动力学不灵活以及对纳米载体的毒性了解欠缺等,这使得多数骨靶向纳米载体难以转化为临床应用。随着研究的不断深入,如何开发出靶向效果更好,生物性能更强,具有缓释及控释功能的骨靶向药物递送系统越来越成为研究热点。因此在未来的研究中还应注意以下几个问题:1)全面系统地了解细胞毒性机制以及纳米载体与各组织器官的相互作用;2)对现有骨靶向递药系统进行优化,提高递送效率和药物负载能力;3)降低成本,寻找适合大规模生产并用于临床的骨靶向纳米载体;4)结合现代化信息技术,实现个性化用药。另外,为了避免药物在递送过程中过早释放,可对纳米载体进行修饰,使之具有氧化还原、光、磁和 pH 等刺激性响应特征,从而减少对健康组织或器官的伤害。尽管如此,关于骨靶向药物递送系统的现有知识对于骨相关疾病的治疗仍具有重要的研究意义与临床价值。
参考文献:
[1] 男性骨质疏松症诊疗指南 [J]. 中华骨质疏松和骨矿盐疾病杂志 , 2020, 13(5): 381-395.
[2] 向海滨,李新霞,梁求真,等 . 特异性骨靶向纳米递药系统的优势与临床可应用性 [J]. 中国组织工程研究 , 2020, 24(04): 612-618.
[3] 刘海峰,白少柏 . 骨靶向递药系统的研究进展 [J]. 中国医药导报 , 2017, 14(3): 64-67.
[4] 张秋珍,陈爽,陈婉瑛,等 . 双膦酸盐类不良反应监测之真实世界研究的挖掘与分析 [J]. 今日药学 , 2022, 32(1): 72-80.
[5] 李奕玉,关雅心,吴斌 . 双膦酸盐治疗原发性骨质疏松症的研究进展 [J]. 实用医学杂志 , 2021, 37(5): 569-573.
[6] 卢翠翠,李伟哲,沈姗,等 . 米诺环素相关皮肤色素沉着的研究进展 [J]. 药物不良反应杂志 , 2021, 23(4): 196-201.
[7] 丁源,陈新,涂家生,等 . 蛋白及多肽类药物长效化制剂学技术研究进展 [J]. 中国药科大学学报 , 2020, 51(4): 433-440.
[8] Vannala V, Palaian S, Shankar P R, et al. Therapeutic dimensions of bisphosphonates: a clinical update[J/OL]. Int J Prev Med, 2020, 11: 166[2022-06-27]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7716604/. DOI: 10.4103/ijpvm.IJPVM_33_19.
[9] 高欢,尹东锋 . 双膦酸盐类药物的生物学应用研究进展 [J]. 中国现代医药杂志 , 2020, 22(11): 104-108.
[10] Farrell K B, Karpeisky A, Thamm D H, et al. Bisphosphonate conjugation for bone specific drug targeting[J/OL]. Bone Rep, 2018, 9: 47-60[2022-06-27]. https://sci-hub.se/10.1016/j.bonr.2018.06.007.
[11] Jing C L, Li B W, Tan H, et al. Alendronate-decorated nanoparticles as bone-targeted alendronate carriers for potential osteoporosis treatment[J/OL]. ACS Appl Bio Mater, 2021, 4: 4907-4916[2022-06-27]. https://sci-hub.se/10.1021/acsabm.1c00199.
[12] Sun W, Ge K, Jin Y, et al. Bone-targeted nanoplatform combining zoledronate and photothermal therapy to treat breast cancer bone metastasis[J/OL]. ACS Nano, 2019, 13: 7556-7567[2022-06-27]. https://sci-hub.se/10.1021/acsnano.9b00097.
[13] Chopra I, Roberts M. Tetracycline antibiotics: mode of action, applications, molecular biology, and epidemiology of bacterial resistance[J]. Microbiol Mol Biol Rev, 2001, 65(2): 232-260.
[14] Wang J, Hu J, Zhang S. Studies on the sorption of tetracycline onto clays and marine sediment from seawater[J]. J Colloid Interface Sci, 2010, 349(2): 578-582.
[15] 邹萍 , 谢永辉 , 邓艾平 . 四环素介导的骨靶向嫁接物胶束的制备及体外评价 [J]. 中国药学杂志 , 2017, 52(14): 1257-1262.
[16] Wang H, Liu J, Tao S, et al. Tetracycline-grafted PLGA nanoparticles as bone-targeting drug delivery system[J/OL]. Int J Nanomed, 2015, 10: 5671-5685[2022-06-27]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4571930/. DOI: 10.2147/IJN.S88798.
[17] Chang C C, Lin T A, Wu S Y, et al. Regeneration of tooth with allogenous, autoclaved treated dentin matrix with dental pulpal stemcells: an in vivo study[J]. J Endod, 2020, 46(9): 1256-1264.
[18] Shi C, Wu T T, He Y, et al. Recent advances in bone-targeted therapy[J/OL]. Pharmacol Ther, 2020, 207: 107473[2022-06-27]. https://sci-hub.se/10.1016/j.pharmthera.2020.107473.
[19] 费晨艳,江银华 . 生长因子在牙槽骨组织再生中的应用与研究进展 [J]. 中国口腔颌面外科杂志 , 2021, 19(6): 568-572.
[20] 胡晨波,彭俊木,钟伟洋,等 . 生长因子纳米载药系统促进组织修复的研究 [J]. 医学信息 , 2021, 34(6): 50-56.
[21] 王军,程少文,陈庆玉,等 . TGF-β 微泡靶向治疗大鼠骨骼肌损伤的实验研究 [J]. 局解手术学杂志 , 2017, 26(9): 630-634.
[22] 唐越 . 超顺磁性壳聚糖载 IGFBP_5 纳米粒靶向治疗骨肉瘤肺转移的实验研究 [D]. 重庆:重庆医科大学 , 2021.
[23] Willson T M, Paul S C, Anthony D B, et al. Bone targeted drugs 1.Identification of heterocycles with hydroxyapatite affinity[J]. Bioorg Med Chem Lett, 1996, 6(9): 1043-1046.
[24] Gao Y, Patil S, Qian A. The role of microRNAs in Bone metabolism and disease[J/OL]. Int J Mol Sci, 2020, 21(17): 6081[2022-06-27]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7503277/. DOI:10.3390/ijms21176081.
[25] 陈莹 . 多级孔二氧化硅微球负载淫羊藿苷对成骨细胞增殖分化的影响 [D]. 佳木斯:佳木斯大学 , 2021.
[26] 陈崧,何远丽,谢雯佳,等 . 磷酸钙纳米颗粒药物递送系统在骨组织工程研究与应用中的优势 [J]. 中国组织工程研究 , 2021, 25(22): 3565-3570.
[27] Wang D, Tabassum A, Wu G, et al. Bone regeneration in critical-sized bone defect enhanced by introducing osteoinductivity to biphasic calcium phosphate granules[J]. Clin Oral Implants Res, 2017, 28(3): 251-260.
[28] Zhang X Y, Liu Q B, Zhang T T, et al. Bone-targeted nanoplatform enables efficient modulation of bone tumor microenvironment for prostate cancer bone metastasis treatment[J/OL]. Drug Deliv, 2022, 29: 889-905[2022-06-27]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8928789/. DOI: 10.1080/10717544.2022.2050845.
[29] 杨雪华 . 载 microRNA-140 金纳米粒的制备及其与氯诺昔康联合治疗骨关节炎的研究 [D]. 济南:山东大学 , 2020.
[30] 孙仁凇,张建斌,房佳霓,等 . 壳聚糖纳米粒作为药物递送系统在癌症治疗中的应用 [J]. 中国临床药理学与治疗学 , 2021, 26(1): 65-75.
[31] 李永恒,崔岩,张治宇 . 载阿霉素壳聚糖纳米粒子可抑制小鼠骨肉瘤 [J]. 中国组织工程研究 , 2019, 23(26): 4194-4199.
[32] Zhao L, Zhang K, Bu W H, et al. Effective delivery of bone morphogenetic protein 2 gene using chitosan-polyethylenimine nanoparticle to promote bone formation[J]. Rsc Adv, 2016, 6(41): 34081-34089.
[33] Cao L Y, Werkmeister J A, Wang J, et al. Bone regeneration using photocrosslinked hydrogel incorporating rhBMP-2 loaded 2-N, 6-O-sulfated chitosan nanoparticles[J/OL]. Biomaterials, 2014, 35: 2730-2742[2022-06-27]. https://sci-hub.se/10.1016/j. biomaterials.2013.12.028.
[34] 白少柏 . 负载多西他赛骨靶向树状聚合物纳米粒的制备及其抗肺癌骨转移瘤活性研究 [D]. 西安:中国人民解放军空军军医大学 , 2018.
[35] 张晓璐,吕邵娃,李永吉 . 聚合物纳米粒子的研究进展 [J]. 精细化工中间体 , 2021, 51(6): 1-5.
[36] 刘永伟 . 骨靶向纳米载药系统介导雌激素治疗绝经后骨质疏松症的实验研究 [D]. 武汉:华中科技大学 , 2019.
[37] 杨坤,李承晔,魏凡华 . PLGA 纳米微球作为 DNA 疫苗载体的研究进展 [J]. 中国兽医科学 , 2021, 51(6): 746-753.
[38] 易自,崔燎 . 脂质体作为骨靶向药物载体的应用研究进展 [J]. 中国骨质疏松杂志 , 2013, 19(12): 1296-1300.
[39] Huang L, Wang X, CAO H, et al. A bone-targeting delivery system carrying osteogenic phytomolecule icaritin prevents osteoporosis in mice[J/OL]. Biomaterials, 2018, 182: 58-71[2022-06-27]. https://sci[1]hub.se/10.1016/j.biomaterials.2018.07.046.
[40] Ahn G Y, Kim S E, Yun T H, et al. Enhanced osteogenic differentiation of alendronate-conjugated nanodiamonds for potential osteoporosis treatment[J/OL]. Biomater Res, 2021, 25: 28[2022-06-27]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8461989/. DOI:10.1186/s40824-021-00231-9.
[41] Tao S, Yu F Y, Song Y Q, et al. Water/pH dual responsive in situ calcium supplement collaborates simvastatin for osteoblast promotion mediated osteoporosis therapy via oral medication[J/OL]. J Controlled Release, 2021, 329: 121-135[2022-06-27]. https://sci-hub.se/10.1016/j.jconrel.2020.11.059.
[42] Yang Q, Liu D Z, Liu M, et al. Bone-targeted calcium phosphate[1]polymer hybrid nanoparticle co-deliver zoledronate and docetaxel to treat bone metastasis of prostate cancer[J/OL]. J Pharm Sci, 2021, 110: 876-887[2022-06-27]. https://sci-hub.se/10.1016/j.xphs.2020.11.005.
[43] Bai S B, Cheng Y, Liu D Z, et al. Bone-targeted PAMAM nanoparticle to treat bone metastases of lung cancer[J/OL]. Nanomedicine (Lond), 2020, 15: 833-849[2022-06-27]. https://sci-hub.se/10.2217/nnm[1]2020-0024.
[44] Yang X Y ,Zhai D L, Song J, et al. Rhein-PEG-nHA conjugate as a bone targeted drug delivery vehicle for enhanced cancer chemoradiotherapy[J/OL]. Nanomedicine, 2020, 27: 102196[2022-06-27]. https://sci-hub.se/10.1016/j.nano.2020.102196.
[45] Wang Y, Liu Z, Li T, et al. Enhanced therapeutic effect of RGD-modified polymeric micelles loaded with low-dose methotrexate and nimesulide on rheumatoid arthritis[J]. Theranostics, 2019, 9(3): 708-720.
[46] Yamashita S, Katsumi H, Hibino N, et al. Development of PEGylated aspartic acid-modified liposome as a bone-targeting carrier for the delivery of paclitaxel and treatment of bone metastasis[J/OL].Biomaterials, 2018, 154: 74-85[2022-06-27]. https://sci-hub.se/10.1016/j.biomaterials.2017.10.053.
[47] Xie Y, Liu C, Huang H, et al. Bone-targeted delivery of simvastatin-loaded PEG-PLGA micelles conjugated with tetracycline for osteoporosis treatment[J]. Drug Deliv Transl Res, 2018, 8(5): 1090-1102.
美编排版:韩杭丽
感谢您阅读《药学进展》微信平台原创好文,也欢迎各位读者转载、引用。本文选自《药学进展》2023年第 8 期。

