转自:药学进展

陈力

复旦大学上海医学院特聘教授,博士生导师。全国卫管协会转化医学分会副会长,应用微生物组学组长;全国微生物学会感染与免疫专委会细菌组副组长,国家口腔疾病重点实验室学术委员会委员,《微生物与感染》副主编。建立了脑膜炎败血伊丽莎白金菌国际全基因组标准参考序列;发现了包括PNGaseF II、cFase1、gpcXase1在内的新型核心糖苷酶系列;提出了糖生物二维码(BioQR)假设;合作报道了亚洲前6例NGLY1/CDG;报道了细胞形变是基因组改变的条件。陈力教授参与了全球第1个靶向抗肿瘤药物索拉菲尼的早期研发(美国Onyx公司);主导了全球第1个唾液检测平台及微创牙科系列产品的研发及上市(日本GC公司);建立了新的抗病毒感染的专利检测方法,合作推动了病原体宏基因组检测技术的转化医学研究。首开《临床生物信息和样本库》课程,助力未来医学及医学教育的发展。提出并倡导“医产学合作”的转化医学新模式。在国内外学术杂志发表论文多篇,并有数十项专利授权及专利申请。
陈萃英

比利时根特大学(GhentUniversity)生物工程博士,先思达(南京)生物科技有限公司董事长。研究方向:生物技术,糖生物学,糖组学。陈博士自2004年任职根特大学及弗兰德斯生物技术研究所(VIB)分子生物医学实验室研究组负责人。领导的研究组开创了后基因组学——糖组学的应用理念,凭借对糖组学这一新型标志物的应用发现与检测技术的重大创新,为糖组学从理论研究到临床应用的迈进奠定了坚实的基础、提供了先进的技术、拓展了广阔的空间。据此成果,陈博士荣获比利时FFMI-肿瘤标志物最新发明奖、欧洲华人十大科技创业创新人物奖,在SCI国际学术期刊上发表50多篇独立研究学术论文,于国内外获得专利授权和申请专利20余项。2012年起,陈博士创建了先思达(南京)生物科技有限公司,建立起国际首个基于糖组学检测技术的测序平台,针对十几项重大疾病种类开发检测、诊断产品。2018年先思达首个肝癌检测诊断产品G-Test寡糖链检测试剂盒被认定为国家创新产品。公司先后与北京大学、复旦大学合作成立糖组学联合实验室与转化医学联合研究中心。陈博士被评聘为中国科协海智专家、江苏省高层次创新创业人才,获批了“十三五”重大新药创制等多项科研基金,并荣获2019年江苏省五一劳动荣誉奖章。
基于糖谱的体外检测和诊断的临床应用研究进展 PPS
孙桂芹1,陈妍雯1,张绍兴1,刘瑞杰1,张瑜芯1,芦鑫荣2,童永亮2,陈力2*,陈萃英3**
(1.浙江中医药大学医学技术与信息工程学院,浙江 杭州310053;2.复旦大学基础医学院病原生物学系,医学分子病毒学教育部/卫健委/中国医科院重点实验室,上海 200032;3.先思达生物科技有限公司,江苏 南京211800)
[摘要] 检测样本中游离及共价连接在糖肽上的寡糖链,构成糖谱。糖谱上寡糖链类型和丰度的变化可能与病理生理改变相关,具重要的诊断价值,并已应用于临床检测。综述糖谱在肿瘤、感染性疾病、自身免疫性疾病、遗传性疾病中的变化,以及糖谱分析在体外诊断中的进展,为糖谱检测的临床应用提供方向。
蛋白质糖基化是真核细胞中发现的最重要的翻译后修饰之一,其对蛋白结构、理化性质等具有重要影响[1],能参与分子识别、免疫应答和细胞间通讯,真核生物内约有50%的蛋白会发生糖基化修饰[2-3]。糖组学是继基因组学、蛋白质组学之后,又一新兴的研究领域。我国在糖生物学、糖分析技术及糖转化医学等领域已取得了突破性进展。研究显示,糖基化与多种疾病的发生发展有关[4],且糖基化检测在疾病诊断中具有良好的特异性,已开发相关检测试剂盒。本文阐述在肿瘤、感染性疾病、自身免疫性疾病、遗传性疾病等中糖基化的改变,糖基化检测标志物,以及目前糖谱检测方法在临床诊断中的应用情况,为糖谱在体外诊断中的开发与应用提供思路。
1
糖基化与疾病
1.1 糖基化与肿瘤
糖基化在调节细胞增殖、细胞信号传导、细胞黏附、细胞外基质相互作用以及近端和远端通讯方面具有重要的功能性作用[2]。异常糖基化可干扰细胞黏附分子如钙黏蛋白和整联蛋白,并改变受体酪氨酸激酶(receptor tyrosine kinase,RTK)的功能,相关糖基化还可以结合凝集素,包括半乳糖凝集素、唾液酸结合免疫球蛋白型凝集素(Siglec)和选择素[3]。核心岩藻糖基化和唾液酸化的异常表达,是肿瘤组织中常见的糖基化类型,与肿瘤的代谢、侵袭及治疗相关[2,4]。
肝细胞癌中异常N-核心岩藻糖基化增加和肺肿瘤组织中蛋白-O-岩藻糖基转移酶(protein Ofucosyltransferase,POFUT)的表达水平升高可以特异地指示癌症进展,当N-核心岩藻糖基化受抑制时肝癌细胞增殖和整合素介导的细胞迁移也被显著抑制[5-7]。基于黑色素瘤的研究发现,核心岩藻糖基转移酶8(fucosyltransferase 8,FUT8)及唾液酸酶在转移性肿瘤细胞中显示出异常丰度,可能促进了黑色素瘤细胞的侵袭、转移及免疫逃逸[8-11]。FUT8的异常表达也可能导致前列腺癌[12]、胰腺导管腺癌[13]、胶质母细胞瘤[9]及乳腺癌[14]的侵袭性行为。
唾液酸残基存在于糖链的游离末端,具有重要的生物功能[15]。细胞表面唾液酸化增加是癌细胞的一个共同特征,唾液酸-T(sT)抗原在乳腺癌、卵巢癌、脑癌和肾癌几种肿瘤类型中均上调,并与患者生存时间缩短相关[16-19]。唾液酸转移酶6(sialyltransferase 6,ST6)特异性介导的Sialyl-Tn抗原(S-Tn),几乎在所有上皮癌中上调,并与患者不良结局相关[20]。
1.2 糖基化与感染性疾病
糖基化与许多感染性疾病相关,如病毒和细菌含有大量糖蛋白,这些蛋白的糖基化修饰与感染密切相关。
病毒的结构蛋白在感染过程中会进行糖基化,其中N-糖基化具有重要作用,与病毒的表达、转运、与细胞表面受体结合以及防止抗体中和等作用密切相关[21]。新冠病毒SARS-CoV-2的刺突蛋白存在广泛的糖基化,抑制其N-糖基化能够增强刺突蛋白水解,减少病毒进入[22]。甲型流感病毒(influenza A virus,IAV)的表面糖蛋白血凝素(hemagglutinin, HA)具有多个N-糖基化位点,且大部分位于HA的头部,对蛋白质的折叠、运输和pH稳定性具有重要作用[23]。研究表明,去除日本脑炎病毒(Japanese encephalitis virus,JEV)膜蛋白prM的N-糖基化后,导致接种病毒后小鼠的病毒毒性急剧下降[24]。
细菌比真核生物和古细菌具有更多的蛋白质糖基化途径,糖基化对细菌的感染具有重要作用[25-26]。此外,细菌表面聚糖可作为毒力因子,如细菌可表达结合基质糖蛋白或黏蛋白的黏附素,与动物细胞上的特定碳水化合物配体相黏附;包裹细菌的多糖胶囊结构可阻碍免疫检查;革兰阴性菌外膜的脂多糖可由先天免疫系统识别并刺激炎症过程[27]。对空肠弯曲菌(Campylobacter jejuni)的蛋白组学研究发现,包括分泌蛋白、膜间质蛋白和内膜结合蛋白等60多种蛋白为N-糖基化蛋白,N-糖基化缺失会抑制空肠弯曲菌在细胞中的定植[28-29]。空肠弯曲菌的鞭毛是其重要毒力因素之一,鞭毛的糖基化对鞭毛的组装和运动至关重要[30]。
1.3 糖基化与自身免疫性疾病
自身免疫性疾病的病因之一是自身抗体的产生,多数自身抗体是免疫球蛋白[31],部分为含有N-糖基化修饰位点的糖蛋白,结构上的糖基化水平不仅影响蛋白理化性质,还会改变免疫球蛋白G(immunoglobulin G,IgG)与Fcγ片段受体(Fc γ fragment receptor,FcγR)或C1q补体的亲和力,使其具有促炎或抗炎活性[32-33]。
已有研究显示,类风湿性关节炎(rheumatoid arthritis,RA)患者的类风湿因子(rheumatoid factor,RF)半乳糖基化、高甘露糖型寡糖链水平下降,导致RF活性增强,血清C反应蛋白水平上升,加重关节炎[34];抗瓜氨酸化蛋白抗体(anti-citrullinated protein antibodies,ACPA)的唾液酸化水平下降,诱导破骨细胞生成,可能有促炎作用[35]。肉芽肿性多血管炎(granulomatosis with polyangiitis, GPA)患者的抗中性粒细胞胞浆抗体(anti-neutrophilic cytoplasmic antibodies,ANCA)唾液酸水平下降,激活γ-干扰素、粒细胞集落刺激因子等,从而引起炎症[36]。桥本甲状腺炎(hashimoto thyroiditis,HT) 患者的甲状腺球蛋白抗体(thyroglobulin antibody, TgAb)甘露糖基化水平升高,但半乳糖基化水平降低,该结果可能与唾液酸糖苷酶相关[37]。上述研究表明,自身抗体的糖基化水平与自身免疫性疾病的发生发展存在关联,但相关机制还需进一步探究。
1.4 糖基化与遗传性疾病
糖基化障碍引起的遗传性疾病通常存在一种或多种糖基化相关酶的功能缺陷,这种缺陷可能发生在糖苷酶或糖基转移酶,导致蛋白(或脂肪)糖基化异常,从而产生存在功能异常的糖蛋白(或糖脂),出现相应的临床表现。先天性糖基化障碍(congenital disorder of glycosylation,CDG)是糖基化异常引起的一类罕见的常染色体隐性遗传性疾病,是由糖蛋白合成相关酶基因变异引起,造成相应糖蛋白合成缺陷[38]。
糖基转移酶基因缺陷会导致CDG的发生。磷酸甘露糖变位酶2(phosphomannomutase 2, PMM2)的变异会引起PMM2先天性糖基化障碍(PMM2-CDG),PMM2基因编码一种将甘露糖-6-磷酸酯(M6P)转化为甘露糖-1-磷酸(M1P)的酶,PMM2缺陷导致GDP-甘露糖的产生减少,以致血清糖蛋白糖基化减少[39]。高尔基体中β-1,4半乳糖基转移酶1(β-1,4-galactosyltransferase,B4GALT1)突变造成的N-糖基化缺陷导致B4GALT1先天性糖基化障碍(B4GALT1-CDG),由于B4GALT1活性降低,转铁蛋白中半乳糖和唾液酸水平显著下降[40]。
去糖基化的糖苷酶基因突变会引起先天性去糖基化障碍(congenital disorder of deglycosylation, CDDG)。由甘露糖寡糖葡萄糖苷酶(mannosyl-oligosaccharide glucosidase,MOGS)缺陷引起的MOGS先天性糖基化障碍(MOGS-CDDG),患者血清糖谱图会显示出高甘露糖化和高唾液酸化,前者可能与炎症或感染相关,后者则影响神经退化和异常免疫调节[41]。NGLY1型先天性去糖基化障碍(NGLY1-CDDG)是由于N-糖苷酶1(N-glycanase 1,NGLY1)缺陷,导致内质网相关降解途径阻滞,错误折叠N-糖蛋白积累,患者出现发育迟缓等症状[42]。ALG1先天性糖基化障碍(ALG1-CDG)患者缺乏将甘露糖添加到壳二糖核心的甘露糖基转移酶,该酶存在于内质网胞质侧并参与N-糖基化生物合成的第一步,该酶的缺乏导致结构不完整的脂质连接寡糖(LLO)的产生[43]。
2
疾病糖基化检测标志物
生物标志物是临床中用于诊疗评估、预后判断的工具,依据功能可分为诊断、预后和预测等类别。糖链组成和结构变化是各类疾病发生的特征之一,因此糖基化修饰水平可能作为有诊断价值的生物标志物。目前,糖基化检测的相关标志物已在疾病诊断中开展,对疾病进展诊断等具有良好的提示作用,同时有助于研究糖基化在疾病中的生物学意义。部分疾病中糖基化体外诊断标志物介绍详见表1。
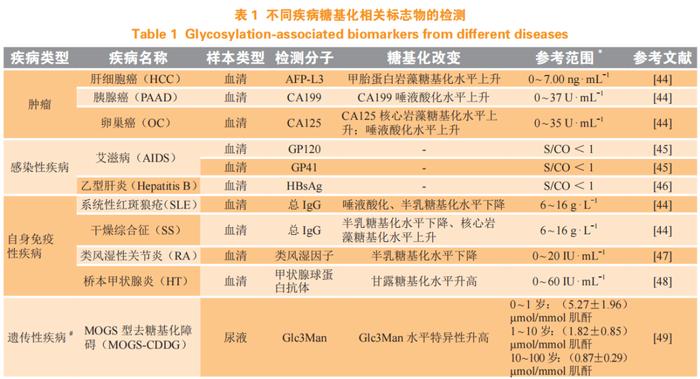

肿瘤糖基化与肿瘤代谢、侵袭性等相关,可作为肿瘤侵袭性预测的生物标志物[2]。美国食品和药品监督管理局(FDA)批准的用于癌症临床用途的9种蛋白质生物标志物均是糖基化蛋白,包括肝癌中的甲胎蛋白(AFP)、卵巢癌中的癌胚抗原125(CA125)和人附睾蛋白4(HE4)、甲状腺癌中的甲状腺球蛋白(Tg)、前列腺癌中的前列腺特异性抗原(PSA)、结直肠癌中的致癌胚胎抗原(CEA)以及乳腺癌中的人类表皮生长因子受体2(HER2)、糖类抗原CA15.3和糖类抗原CA27.29[52-54]。此外,胰腺癌中的糖类抗原CA199也是潜在的肿瘤标志物[55]。
目前,针对感染性疾病中的糖基化相关蛋白,人类免疫缺陷病毒(human immunodeficiency virus,HIV)表面的糖蛋白GP120、GP41等,能促进病毒和细胞膜结合,是HIV感染的重要检测指标[45]。乙肝表面抗原(hepatitis B surface antigen, HBsAg)同样为乙型肝炎病毒(hepatitis B virus, HBV)表面的糖蛋白,是HBV感染的重要标志[46]。
自身免疫性疾病中,系统性红斑狼疮患者血清IgG中唾液酸化、半乳糖基化水平下降;干燥综合征患者血清IgG中半乳糖基化水平下降、核心岩藻糖基化水平上升,可结合自身特异性抗体对疾病开展鉴别诊断。炎症性肠病患者的血清IgG上含有半乳糖的G2型糖链减少,而G0型糖链增多,G0/G2的比值与疾病进程相关,可用于该疾病的临床诊断[56]。对关节炎小鼠输注唾液酸转移酶,提高血清总IgG唾液酸水平,结果小鼠关节的炎症渗入减少、组织破坏程度减轻[57],说明其糖基化水平能显示疾病状态。
除此之外,与糖基化相关的遗传性疾病CDG,因其相关基因及表型众多,且不同CDG可出现相同表型、同一CDG存在众多不同表型,因此CDG诊断缺乏简单快速的筛查方法。大部分CDG可通过血液检测初步筛查,现也有研究通过检测尿液中糖链诊断CDG[49-50]。
3
糖谱检测技术与方法
规范化、流程化的糖基化检测方法,是相关疾病体外诊断的前提条件,可为临床应用的转化提供基础。现有的检测流程为制备或富集糖链样本后,再经质谱(mass spectrometry,MS)、毛细管电泳(capillary electrophoresis,CE)等方法对糖链结构进行分离鉴定,对糖谱开展全面分析。下文简要叙述了目前常用的N-糖链样本前处理和检测方法。
3.1 样本处理
3.1.1 游离寡糖富集 凝集素是一种非免疫来源的蛋白质,它与寡糖或糖肽特异性地相互作用而不会改变其性状。Yodoshi等[58]使用植物凝集素可特异性回收糖蛋白衍生的低聚寡糖,使用蓖麻凝集素可将卵清蛋白中2-氨基吡啶标记的低聚寡糖基团分离为半乳糖和无乳糖,使用小麦胚芽凝集素可分离高甘露糖和杂交型低聚寡糖。植物凝集素对可通过富集低聚寡糖进行凝集素亲和毛细管电泳和凝集素微阵列,用于糖蛋白组学分析[59-60]。
3.1.2 糖蛋白的糖链制备 利用去糖基化方法,得到糖蛋白上的糖链,处理方法包括酶切法、化学水解法和物理辅助法等。对于N-连接糖肽,酶法可利用内切N-糖苷酶PNGase F 和 PNGase F-Ⅱ水解N-乙酰氨基葡萄糖(GlcNAc)和天冬酰胺(Asn)间的酰胺键,温和高效地得到完整N-糖链[61-62];或者使用外切糖苷酶唾液酸酶、β-半乳糖苷酶等,专一性逐个释放糖基,该方法称为“Cut-Heat-Cutassay”,适用于糖链结构解析[63]。化学水解法是利用肼解法、高碘酸氧化法等方法,在不破坏糖链完整性的情况下获得糖链,反应速率快,但对糖链水解的彻底性不足,易造成蛋白变性[64-65]。物理辅助法是在酶法的基础上,采用压力循环技术和固定化酶技术,提高酶处理速率的同时减少酶量[66],反应过程更稳定,但该技术操作复杂,需进一步优化条件。
3.1.3 糖肽富集 亲水相互作用色谱法因其操作简单、重现性好、与MS的相容性好以及对多种糖肽的无偏差亲和力受到广泛应用,其中,亲水性材料是亲水作用液相色谱法(hydrophilic interaction chromatography,HILIC)的关键,因其可以提供与多糖链上羟基的特异性亲水作用[67]。金属有机骨架是通过金属离子和有机配体的组装而构建的一类多孔材料,具有均匀的结构、超高的比表面积,为特定靶标提供更易接近的结合位点和转移通道,这增加了用于富集的主客体相互作用[68]。用二元配体一步合成了一种具有游离羧基的亲水金属有机骨架(UiO-66-COOH),具有更强的亲水性,更好的糖肽选择性及富集效果,可以重复使用5次,MS谱几乎没有变化,在-20℃储存2个月后也保持了良好的稳定性[69]。
3.2 糖检测方法
快速发展的检测技术,已能根据检测样本的种类,解析糖链结构、糖基化位点等糖谱信息,为糖生物学及糖谱检测在临床疾病中的应用研究提供可靠工具。与传统的单一因子检测相比,糖链和糖肽检测的主要特点是多因子图谱分析。目前,图谱中单一糖链/糖肽的检出要求是两次被检出(PSM=2)、母离子的信噪比S/N大于6。
3.2.1 寡糖链分析 在糖组学研究中通常需要将寡糖链从蛋白主链上释放出来进行详细分析,寡糖链的常用分析方法有MS技术、液相色谱技术、CE技术、核磁共振(nuclear magnetic resonance,NMR)波谱技术。
MS技术是目前最常用的糖链分析技术,能够根据质谱峰的分子量和峰高分别判断糖链结构和糖链含量。如电喷雾串联质谱(ESI-MS/MS)已被用于合成肝素低聚寡糖的测序,且能够分析低分子量肝素(LMWH)这类复杂混合物[70]。
CE技术也是糖组学检测中一种成熟的检测技术,通过高压电场驱动,将不同构型的糖链分离并检测。CE能被用于肝癌早期筛查,因其低成本、高通量、高灵敏度等特性,能够实现临床转化[71]。CE在肝癌检测中的应用现已形成了成熟的糖组学检测产品,产生了首个糖组学相关试剂盒——G-Test检测试剂盒。Zhu等[72]利用G-Test研究肝癌早筛,G-Test对肝癌和甲胎蛋白阴性肝癌(AFP-NHCC)患者具有很高的检出水平,在对健康者和肝硬化患者监测肝癌发病中具有较高的灵敏度和特异性。
液相色谱技术常与MS技术联用来检测糖链,通过色谱柱分离寡糖链并检测。HILIC在检测核糖核酸酶B(ribonuclease B,RNase B)、IgG和胎球蛋白寡糖时能实现较好分离度[73]。高效液相色谱(high performance liquid chromatography,HPLC)技术与MS技术联用,提高了检测的灵敏度,在糖胺聚糖(glycosaminoglycans,GAGs)检测中极大增强了GAGs衍生低聚糖复杂混合物的表征,有利于检测其结构信息与二糖组成[74]。
液态NMR波谱能够分析糖的连接形式,推测糖苷键的构型。NMR是硫酸化聚糖结构分析中最常用的分析技术[75]。通过高分辨率1H-NMR波谱法能够测定人血清α-1-抗胰凝乳蛋白酶聚糖的完整一级结构[76]。
3.2.2 糖肽分析 前期制备获得的糖肽样本,可用于进行糖链的定性和定量分析,并获得位点特异性糖链信息,即微观不均一性。该方法利用液相色谱-MS表征技术,N-糖肽样品经过MS的二级碎裂,寡糖链离子化、肽段骨架碎裂,将所得的实验二级谱图与糖肽的理论碎片离子进行匹配[77],通过GlycoFragWork、GPFinder、pGlyco3等软件,同时鉴定糖基化位点和肽段序列[78-79]。
3.2.3 糖蛋白分析 定量糖蛋白组学可检测蛋白质水平上的糖基化情况,定性定量地针对特异性糖蛋白开展分析。Sun等[80]提出了一种高通量位点特异性糖蛋白组的研究方法,通过引入三级胺化学标签增加糖肽的电荷数,引入等重同位素定量标签增加糖肽在高能碰撞诱导解离中的碎裂效率,将传统方法的分析时间缩短至1/10,同时将糖肽的鉴定率提高了3倍,平衡了N-糖基化蛋白质组研究的通量和鉴定深度。
4
结语与展望
研究及临床数据表明,蛋白糖链信号与疾病的发生、发展和预后相关,具有重要的诊断意义和发现新型生物标志物的潜力。受定量分析手段的限制,糖链信号检测多为定性分析,主要通过糖谱间糖峰的比对获取信息。开发精准糖链信号检测方法,寻找可用于疾病诊断的量化标志物,是未来糖链诊断的方向和挑战。
基于糖组的靶向治疗,为个体化诊疗提供了新的可能性。唾液酸转移酶抑制剂、抗体-唾液酸酶缀合物等抗肿瘤药物开发正在进行中。以糖链合成和修饰蛋白为靶点的新药筛选,为新型抗感染药物和疫苗开发打开了窗口。糖基化与自身性免疫疾病发病机制间的相关性的研究也正在进行中。此外,糖组学分析为先天性糖基化障碍的确诊及疗效的判断提供了可行方案。
参考文献:
[1] Croci D O, Cerliani J P, Dalotto-Moreno T, et al. Glycosylation-dependent lectin-receptor interactions preserve angiogenesis in anti-VEGF refractory tumors[J]. Cell, 2014, 156(4): 744-758.
[2] Pinho S S, Reis C A. Glycosylation in cancer: mechanisms and clinical implications[J]. Nat Rev Cancer, 2015, 15(9): 540-555.
[3] Munkley J. Aberrant sialylation in cancer: therapeutic opportunities[J]. Cancers (Basel), 2022, 14(17): 4248. DOI: 10.3390/cancers14174248.
[4] Li D, Jia S, Wang S, et al. Glycoproteomic analysis of urinary extracellular vesicles for biomarkers of hepatocellular carcinoma[J]. Molecules, 2023, 28(3): 1293. DOI: 10.3390/molecules28031293.
[5] Leng Q, Tsou J H, Zhan M, et al. Fucosylation genes as circulating biomarkers for lung cancer[J]. J Cancer Res Clin Oncol, 2018, 144(11): 2109-2115.
[6] Nouso K, Kobayashi Y, Nakamura S, et al. Prognostic importance of fucosylated alpha-fetoprotein in hepatocellular carcinoma patients with low alpha-fetoprotein[J]. J Gastroenterol Hepatol, 2011, 26(7): 1195- 1200.
[7] Zhou Y, Fukuda T, Hang Q, et al. Inhibition of fucosylation by 2-fluorofucose suppresses human liver cancer HepG2 cell proliferation and migration as well as tumor formation[J]. Sci Rep, 2017, 7(1): 11563. DOI: 10.1038/s41598-017-11911-9.
[8] Tada K, Ohta M, Hidano S, et al. Fucosyltransferase 8 plays a crucial role in the invasion and metastasis of pancreatic ductal adenocarcinoma[J]. Surg Today, 2020, 50(7): 767-777.
[9] Pieri V, Gallotti A L, Drago D, et al. Aberrant L-fucose accumulation and increased core fucosylation are metabolic liabilities in mesenchymal glioblastoma[J]. Cancer Res, 2023, 83(2): 195-218.
[10] Guo D, Guo J, Li X, et al. Enhanced motility and proliferation by miR- 10b/FUT8/p-AKT axis in breast cancer cells[J]. Oncol Lett, 2018, 16(2): 2097-2104.
[11] Tu C F, Wu M Y, Lin Y C, et al. FUT8 promotes breast cancer cell invasiveness by remodeling TGF-beta receptor core fucosylation[J]. Breast Cancer Res, 2017, 19(1): 111. DOI: 10.1186/s13058-017-0904-8.
[12] Höti N, Yang S, Hu Y, et al. Overexpression of α(1,6) fucosyltransferase in the development of castration-resistant prostate cancer cells[J]. Prostate Cancer Prostatic Dis, 2018, 21(1): 137-146.
[13] Link-Lenczowski P, Lityńska A. Glycans in melanoma screening. Part 2. Towards the understanding of integrin N-glycosylation in melanoma[J]. Biochem Soc Trans, 2011, 39(1): 374-377.
[14] Agrawal P, Fontanals-Cirera B, Sokolova E, et al. A systems biology approach identifies FUT8 as a driver of melanoma metastasis[J]. Cancer Cell, 2017, 31(6): 804-819.e7. DOI: 10.1016/j.ccell.2017.05.007.
[15] Rodrigues E, Macauley M S. Hypersialylation in cancer: modulation of inflammation and therapeutic opportunities[J]. Cancers (Basel), 2018, 10(6): 207. DOI: 10.3390/cancers10060207.
[16] Burchell J, Poulsom R, Hanby A, et al. An alpha2, 3 sialyltransferase (ST3Gal I) is elevated in primary breast carcinomas[J]. Glycobiology, 1999, 9(12): 1307-1311.
[17] Wu X, Zhao J, Ruan Y, et al. Sialyltransferase ST3GAL1 promotes cell migration, invasion, and TGF-beta1-induced EMT and confers paclitaxel resistance in ovarian cancer[J]. Cell Death Dis, 2018, 9(11): 1102. DOI: 10.1038/s41419-018-1101-0.
[18] Chong Y K, Sandanaraj E, Koh L W H, et al. ST3GAL1-associated transcriptomic program in glioblastoma tumor growth, invasion, andprognosis[J]. J Natl Cancer Inst, 2016, 108(2): djv326. DOI: 10.1093/ jnci/djv326.
[19] Bai Q, Liu L, Xia Y, et al. Prognostic significance of ST3GAL-1 expression in patients with clear cell renal cell carcinoma[J]. BMC Cancer, 2015, 15: 880. DOI: 10.1186/s12885-015-1906-5.
[20] Munkley J. The role of sialyl-Tn in cancer[J]. Int J Mol Sci, 2016, 17(3): 275. DOI: 10.3390/ijms17030275.
[21] Feng T, Zhang J, Chen Z, et al. Glycosylation of viral proteins: implication in virus-host interaction and virulence[J]. Virulence, 2022, 13(1): 670-683.
[22] Yang Q, Hughes T A, Kelkar A, et al. Inhibition of SARS-CoV-2 viral entry upon blocking N- and O-glycan elaboration[J]. Elife, 2020, 9: e61552. DOI: 10.7554/eLife.61552.
[23] Tsuchiya E, Sugawara K, Hongo S, et al. Role of overlapping glycosylation sequons in antigenic properties, intracellular transport and biological activities of influenza A/H2N2 virus haemagglutinin[J]. J Gen Virol, 2002, 83(Pt 12): 3067-3074.
[24] Kim J M, Yun S I, Song B H, et al. A single N-linked glycosylation site in the Japanese encephalitis virus prM protein is critical for cell type[1]specific prM protein biogenesis, virus particle release, and pathogenicity in mice[J]. J Virol, 2008, 82(16): 7846-7862.
[25] Dell A, Galadari A, Sastre F, et al. Similarities and differences in the glycosylation mechanisms in prokaryotes and eukaryotes[J]. Int J Microbiol, 2010, 2010: 148178. DOI: 10.1155/2010/148178.
[26] Valguarnera E, Kinsella R L, Feldman M F. Sugar and spice make bacteria not nice: protein glycosylation and its influence in pathogenesis[J]. J Mol Biol, 2016, 428(16): 3206-3220.
[27] Wiederschain G Y. Essentials of glycobiology[J]. Biochemistry (Moscow), 2009, 74(9): 1056. DOI: 10.1101/9781621824213.
[28] Scott N E, Parker B L, Connolly A M, et al. Simultaneous glycan[1]peptide characterization using hydrophilic interaction chromatography and parallel fragmentation by CID, higher energy collisional dissociation, and electron transfer dissociation MS applied to the N-linked glycoproteome of Campylobacter jejuni[J]. Mol Cell Proteomics, 2011, 10(2): M000031-MCP201. DOI: 10.1074/mcp. M000031-MCP201.
[29] Szymanski C M, Burr D H, Guerry P. Campylobacter protein glycosylation affects host cell interactions[J]. Infect Immun, 2002, 70(4): 2242-2244.
[30] Zhu F, Wu H. Insights into bacterial protein glycosylation in human microbiota[J]. Sci China Life Sci, 2016, 59(1): 11-18.
[31] Wahren-Herlenius M, Dörner T. Immunopathogenic mechanisms of systemic autoimmune disease[J]. Lancet, 2013, 382(9894): 819-831.
[32] Aoyama M, Hashii N, Tsukimura W, et al. Effects of terminal galactose residues in mannose alpha1-6 arm of Fc-glycan on the effector functions of therapeutic monoclonal antibodies[J]. MAbs, 2019, 11(5): 826-836.
[33] Aoyagi Y, Saitoh A, Suzuki Y, et al. Fucosylation index of alpha[1]fetoprotein, a possible aid in the early recognition of hepatocellular carcinoma in patients with cirrhosis[J]. Hepatology, 1993, 17(1): 50-52.
[34] Matsumoto A, Shikata K, Takeuchi F, et al. Autoantibody activity of IgG rheumatoid factor increases with decreasing levels of galactosylation and sialylation[J]. J Biochem, 2000, 128(4): 621-628.
[35] Harre U, Lang S C, Pfeifle R, et al. Glycosylation of immunoglobulin G determines osteoclast differentiation and bone loss[J]. Nat Commun, 2015, 6: 6651. DOI: 10.1038/ncomms7651.
[36] Wuhrer M, Stavenhagen K, Koeleman C A, et al. Skewed Fc glycosylation profiles of anti-proteinase 3 immunoglobulin G1 autoantibodies from granulomatosis with polyangiitis patients show low levels of bisection, galactosylation, and sialylation[J]. J Proteome Res, 2015, 14(4): 1657-1665.
[37] Yuan S, Li Q, Zhang Y, et al. Changes in anti-thyroglobulin IgG glycosylation patterns in Hashimoto's thyroiditis patients[J]. J Clin Endocrinol Metab, 2015, 100(2): 717-724.
[38] Jaeken J, Péanne R. What is new in CDG?[J]. J Inherit Metab Dis, 2017, 40(4): 569-586.
[39] Klaver E J, Dukes-Rimsky L, Kumar B, et al. Protease-dependent defects in N-cadherin processing drive PMM2-CDG pathogenesis[J]. JCI Insight, 2021, 6(24): e153474. DOI: 10.1172/jci.insight.153474.
[40] van den Boogert M A W, Crunelle C L, Ali L, et al. Reduced CETP glycosylation and activity in patients with homozygous B4GALT1 mutations[J]. J Inherit Metab Dis, 2020, 43(3): 611-617.
[41] Abuduxikuer K, Wang L, Zou L, et al. Updated clinical and glycomic features of mannosyl-oligosaccharide glucosidase deficiency: two case reports[J]. World J Clin Cases, 2022, 10(21): 7397-7408.
[42] 袁舒颖 , 邹琳 , 库尔班江 · 阿布都西库尔 , 等 . 罕见病 NGLY1 型 先天性去糖基化障碍 CDDG 的临床和基础研究进展 [J]. 浙江临 床医学 , 2020, 22(12): 1845-1848.
[43] González-Domínguez C A, Fiesco-Roa M O, Gómez-Carmona S, et al. ALG1-CDG caused by non-functional alternative splicing involving a novel pathogenic complex allele[J]. Front Genet, 2021, 12: 744884. DOI: 10.3389/fgene.2021.744884.
[44] 尚红 , 王毓三 , 申子瑜 . 全国临床检验操作规程 [M]. 北京:人民 卫生出版社 , 2015: 533-539.
[45] Teixeira C, Gomes J R, Gomes P, et al. Viral surface glycoproteins, GP120 and GP41, as potential drug targets against HIV-1: brief overview one quarter of a century past the approval of zidovudine, the first anti-retroviral drug[J]. Eur J Med Chem, 2011, 46(4): 979-992.
[46] Verheyen J, Neumann-Fraune M, Berg T, et al. The detection of HBsAg mutants expressed in vitro using two different quantitative HBsAg assays[J]. J Clin Virol, 2012, 54(3): 279-281.
[47] 中华医学会风湿病学分会 . 2018 中国类风湿关节炎诊疗指南 [J]. 中华内科杂志 , 2018, 57(4): 242-251.
[48] Fisher D A, Oddie T H, Johnson D E, et al. The diagnosis of Hashimoto's thyroiditis[J]. J Clin Endocrinol Metab, 1975, 40(5): 795-801.
[49] Post M A, de Wit I, Zijlstra F S M, et al. MOGS-CDG: quantitative analysis of the diagnostic Glc3Man tetrasaccharide and clinical spectrum of six new cases[J]. J Inherit Metab Dis, 2023, 46(2): 313- 325.
[50] Haijes H A, de Sain-van der Velden M G M, Prinsen H C M T, et al. Aspartylglycosamine is a biomarker for NGLY1-CDDG, a congenital disorder of deglycosylation[J]. Mol Genet Metab, 2019, 127(4): 368- 372.
[51] van Scherpenzeel M, Steenbergen G, Morava E, et al. High-resolution mass spectrometry glycoprofiling of intact transferrin for diagnosis and subtype identification in the congenital disorders of glycosylation[J]. Transl Res, 2015, 166(6): 639-649.e1.
[52] Badr H A, Alsadek D M M, Darwish A A, et al. Lectin approaches for glycoproteomics in FDA-approved cancer biomarkers[J]. Expert Rev Proteomics, 2014, 11(2): 227-236.
[53] Ludwig J A, Weinstein J N. Biomarkers in cancer staging, prognosis and treatment selection[J]. Nat Rev Cancer, 2005, 5(11): 845-856.
[54] Saldova R, Struwe W B, Wynne K, et al. Exploring the glycosylation of serum CA125[J]. Int J Mol Sci, 2013, 14(8): 15636-15654.
[55] Luo G, Jin K, Deng S, et al. Roles of CA19-9 in pancreatic cancer: biomarker, predictor and promoter[J]. Biochim Biophys Acta Rev Cancer, 2021, 1875(2): 188409. DOI: 10.1016/j.bbcan.2020.188409.
[56] Shinzaki S, Iijima H, Nakagawa T, et al. IgG oligosaccharide alterations are a novel diagnostic marker for disease activity and the clinical course of inflammatory bowel disease[J]. Am J Gastroenterol, 2008, 103(5): 1173-1181.
[57] Pagan J D, Kitaoka M, Anthony R M. Engineered sialylation of pathogenic antibodies in vivo attenuates autoimmune disease[J]. Cell, 2018, 172(3): 564-577.e13.
[58] Yodoshi M, Oyama T, Masaki K, et al. Affinity entrapment of oligosaccharides and glycopeptides using free lectin solution[J]. Anal Sci, 2011, 27(4): 395. DOI: 10.2116/analsci.27.395.
[59] Hirabayashi J. Concept, strategy and realization of lectin-based glycan profiling[J]. J Biochem, 2008, 144(2): 139-147.
[60] Nakajima K, Oda Y, Kinoshita M, et al. Capillary affinity electrophoresis for the screening of post-translational modification of proteins with carbohydrates[J]. J Proteome Res, 2003, 2(1): 81-88.
[61] Plummer Jr T H, Elder J H, Alexander S, et al. Demonstration of peptide: N-glycosidase F activity in endo-beta-N-acetylglucosaminidase F preparations[J]. J Biol Chem, 1984, 259(17): 10700-10704.
[62] Sun G, Yu X, Bao C, et al. Identification and characterization of a novel prokaryotic peptide: N-glycosidase from Elizabethkingia meningoseptica[J]. J Biol Chem, 2015, 290(12): 7452-7462.
[63] Hou L, Li T, Chen H, et al. Identification and characterization of a novel glycoprotein core xylosidase from the bacterium Elizabethkingia meningoseptica[J]. Biochem Biophys Res Commun, 2019, 517(2): 390- 397.
[64] Hong J C, Kim Y S. Alkali-catalyzed beta-elimination of periodate-oxidized glycans: a novel method of chemical deglycosylation of mucin gene products in paraffin embedded sections[J]. Glycoconj J, 2000, 17(10): 691-703.
[65] Douglass J F, Jaya N N, Vedvick T S, et al. Chemical deglycosylation can induce methylation, succinimide formation, and isomerization[J]. J Protein Chem, 2001, 20(7): 571-576.
[66] Szigeti M, Bondar J, Gjerde D, et al. Rapid N-glycan release from glycoproteins using immobilized PNGase F microcolumns[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2016, 1032: 139-143. DOI: 10.1016/j.jchromb.2016.02.006.
[67] McCalley D V. Understanding and manipulating the separation in hydrophilic interaction liquid chromatography[J]. J Chromatogr A, 2017, 1523: 49-71. DOI: 10.1016/j.chroma.2017.06.026.
[68] Wang J, Wang X, Li J, et al. A novel hydrophilic MOFs-303- functionalized magnetic probe for the highly efficient analysis of N-linked glycopeptides[J]. J Mater Chem B, 2022, 10(12): 2011-2018.
[69] Liu Q, Xie Y, Deng C, et al. One-step synthesis of carboxyl[1]functionalized metal-organic framework with binary ligands for highly selective enrichment of N-linked glycopeptides[J]. Talanta, 2017, 175: 477-482. DOI: 10.1016/j.talanta.2017.07.067.
[70] Wang Z, Zhang T, Xie S, et al. Sequencing the oligosaccharide pool in the low molecular weight heparin dalteparin with offline HPLC and ESI-MS/MS[J]. Carbohydr Polym, 2018, 183: 81-90. DOI: 10.1016/ j.carbpol.2017.11.039.
[71] 王蕾 , 李维泉 , 陈力 , 等 . 糖组检测在肝脏疾病诊疗中的应用现 状与未来展望 [J]. 药学进展 , 2021, 45(11): 827-834.
[72] Zhu W, Shi P, Liang A, et al. The combination of serum oligosaccharide chain (G-test), alpha-fetoprotein, and aspartate aminotransferase to alanine aminotransferase ratio provides the optimal diagnostic value for early detection of hepatocellular carcinoma[J]. BMC cancer, 2022, 22(1): 1061. DOI: 10.1186/s12885-022-10139-9.
[73] Ahn J, Bones J, Yu Y Q, et al. Separation of 2-aminobenzamide labeled glycans using hydrophilic interaction chromatography columns packed with 1.7 microm sorbent[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2010, 878(3/4): 403-408.
[74] Volpi N, Linhardt R J. High-performance liquid chromatography-mass spectrometry for mapping and sequencing glycosaminoglycan-derived oligosaccharides[J]. Nat Protoc, 2010, 5(6): 993-1004.
[75] Soares P A G, Queiroz I N L, Pomin V H. NMR structural biology of sulfated glycans[J]. J Biomol Struct Dyn, 2017, 35(5): 1069-1084.
[76] Laine A, Hachulla E, Strecker G, et al. Structure determination of the glycans of human-serum alpha 1-antichymotrypsin using 1 H-NMR spectroscopy and deglycosylation by N-glycanase[J]. Eur J Biochem, 1991, 197(1): 209-215.
[77] Dodds E D. Gas-phase dissociation of glycosylated peptide ions[J]. Mass Spectrom Rev, 2012, 31(6): 666-682.
[78] Zhu Z, Su X, Go E P, et al. New glycoproteomics software, GlycoPep Evaluator, generates decoy glycopeptides de novo and enables accurate false discovery rate analysis for small data sets[J]. Anal Chem, 2014, 86(18): 9212-9219.
[79] Zeng W F, Cao W Q, Liu M Q, et al. Precise, fast and comprehensive analysis of intact glycopeptides and modified glycans with pGlyco3[J]. Nat Methods, 2021, 18(12): 1515-1523.
[80] Sun Z, Fu B, Wang G, et al. High-throughput site-specific N-glycoproteomics reveals glyco-signatures for liver disease diagnosis[J]. Natl Sci Rev, 2023, 10(1): nwac059. DOI: 10.1093/nsr/ nwac059.
美编排版:周佳昕

