转自:药明康德
本期看点
1. Fore Biotherapeutics公司公布其下一代选择性BRAF抑制剂plixorafenib的积极早期临床数据,plixorafenib在携带BRAF突变的晚期患者(包括原发性中枢神经系统肿瘤患者)中表现出持久的抗肿瘤活性,并具有良好的安全性和耐受性。
2. Evaxion公司公布了其利用人工智能(AI)选择肿瘤相关新抗原定制的个体化癌症疫苗EVX-01的1期临床数据,客观缓解率达67%(8/12),2名患者达到完全缓解(CR)。
3. Travere Therapeutics公司开发的旨在解决经典同型半胱氨酸尿症(HCU)根本原因的新型酶替代疗法pegtibatinase的早期临床结果积极,4名患者的总同型半胱氨酸水平与基线相比平均相对减少67.1%,具有临床意义。
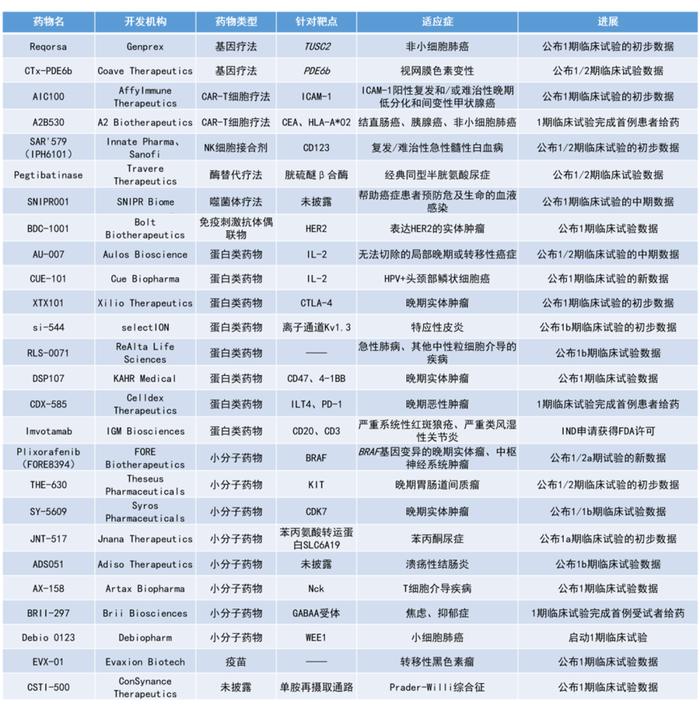
Plixorafenib(FORE8394):公布1/2a期试验的新数据
Fore Biotherapeutics公司公布了其新型下一代选择性BRAF抑制剂plixorafenib在BRAF激活变异的晚期肿瘤患者中的1/2a期临床试验的新数据。Plixorafenib旨在靶向广泛的BRAF突变,同时不影响野生型RAF的活性。
研究结果显示,在未使用过MAPK抑制剂和使用过MAPK抑制剂的BRAF V600+患者中,ORR分别为37.5%和16.7%,中位缓解持续时间分别为32.3个月和12.9个月。在未使用过MAPK抑制剂的BRAF V600+患者中,中位无进展生存期(PFS)超过2年。此外,在包括高级别和低级别胶质瘤在内的原发性中枢神经系统肿瘤中也观察到了plixorafenib的疗效。安全性方面,plixorafenib具有良好的耐受性,仅有1名参与者因治疗相关的不良事件而停止治疗。与已获批的BRAF抑制剂的早期单药数据相比,没有发生继发性的皮肤恶性肿瘤。
EVX-01:公布1期临床试验数据
Evaxion公司公布了其个体化癌症疫苗EVX-01用于治疗转移性黑色素瘤的1期临床试验的积极数据。EVX-01是一种基于Evaxion专有的AI驱动PIONEER技术平台开发的创新个体化新抗原肿瘤疫苗,以脂质体/多肽为载体。值得注意的是,该平台能够在24小时内从DNA和mRNA测序数据中识别具有免疫原性的新抗原表位。大多数新抗原产生于患者之间不共享的独特突变,识别免疫原性新抗原是建立有效个体化癌症免疫疗法的核心。
此次公布的结果显示,所有12名患者均诱导了广泛的新抗原T细胞反应,其中8名(67%)患者达客观缓解,包括2名达到CR的患者和6名达到部分缓解(PR)的患者。此外,EVX-01治疗的耐受性良好,只有轻微的1-2级疫苗相关不良事件。
Pegtibatinase:公布1/2期临床试验数据
Travere Therapeutics公司公布了其新型在研酶替代疗法pegtibatinase用于治疗经典HCU的1/2期临床试验中队列6的积极数据。HCU是一种罕见的遗传代谢疾病,由胱硫醚β合酶(CBS)缺陷引起。CBS缺陷会导致同型半胱氨酸达到毒性水平,从而导致危及生命的中风、心脏病发作,此外还会导致眼科问题和骨骼并发症以及发育迟缓。Pegtibatinase是一种经聚乙二醇化修饰的重组酶替代疗法,旨在解决经典HCU的根本原因。
临床前研究中,pegtibatinase已被证明能够降低总同型半胱氨酸水平并改善临床参数。此前,pegtibatinase已获得FDA授予的突破性疗法认定、罕见儿科疾病认定和快速通道资格,以及美国和欧洲的孤儿药资格。此次公布的结果显示,接受最高剂量pegtibatinase治疗的4名患者的总同型半胱氨酸水平与基线相比平均相对减少67.1%,具有临床意义。截至目前,该候选疗法的耐受性良好,公司预计在2023年年底前启动关键性3期临床试验。
Reqorsa:公布1期临床试验的初步数据
Genprex公司公布了其候选基因疗法Reqorsa联用奥希替尼(osimertinib)的1期临床试验的积极结果。Reqorsa由带有正电荷的脂质分子纳米颗粒包裹着抑癌基因TUSC2组成,而肿瘤细胞一般带有负电荷。Reqorsa经静脉注射,能特异性靶向肿瘤细胞。Reqorsa具有多模式的作用机制,可中断引起肿瘤细胞复制和增殖的细胞信号通路,重新建立肿瘤细胞程序性死亡通路,并调节针对肿瘤细胞的免疫反应。Reqorsa也被证明可以阻断产生耐药性的机制。
此次试验针对接受奥希替尼治疗后疾病进展的携带EGFR突变的晚期非小细胞肺癌(NSCLC)患者。公布的结果显示,Reqorsa的耐受性良好,没有剂量限制性毒性。接受治疗的8例患者中已有2名患者表现出潜在的治疗效果。1名患者达到了PR,另1名患者达到了疾病稳定(SD),这些患者的PFS已显著长于此前几项临床试验中在相同治疗环境下观察到的单用奥希替尼患者的中位PFS。此研究中Reqorsa组的长期PFS与之前针对Reqorsa开展的临床试验中观察到的长期PFS保持一致。
CTx-PDE6b:公布1/2期临床试验数据
Coave Therapeutics公司公布了其创新基因疗法CTx-PDE6b用于治疗由PDE6b双等位基因突变引起的视网膜色素变性(RP)的1/2期临床试验的积极数据。RP是一种遗传性视网膜营养不良,患者会在中年时失明,其特征是光感受器逐渐丧失。目前没有批准的针对PDE6b突变的RP治疗方法。
CTx-PDE6b旨在将功能性的人类PDE6b基因的全长非突变拷贝递送到视网膜下,然后在感光的视杆细胞中快速诱导功能性PDE6b蛋白的稳健表达和合成,从而有望稳定或阻止PDE6b突变患者的视网膜退化。此次公布的数据显示,接受治疗12个月时,两种剂量的CTx-PDE6b在患者中的耐受性均良好,最高剂量的CTx-PDE6b对患者视觉功能的改善被证明有临床意义。
AIC100:公布1期临床试验的初步数据
AffyImmune Therapeutics公司公布了其靶向细胞间粘附分子-1(ICAM-1)的第三代CAR-T细胞疗法AIC100用于治疗间变性甲状腺癌(ATC)和低分化甲状腺癌(PDTC)的1期临床试验的积极安全性和早期疗效结果。
此次公布的结果显示,AIC100的安全性和疗效令人鼓舞。接受治疗的7名患者中,2名患者出现了短暂的1级细胞因子释放综合征(CRS)。2名接受了剂量水平(DL)2的患者在接受治疗后的第42天可进行疗效评估,1名ATC患者达到了PR,病灶缩小了42%,另一名PDTC患者达到了SD。
SAR'579(IPH6101):公布1/2期临床试验的初步数据
Innate Pharma公司公布了其与赛诺菲(Sanofi)共同开发的NK细胞衔接蛋白SAR'579在1/2期临床试验中的剂量递增安全性和初步疗效。SAR'579是一种基于ANKET平台设计的靶向CD123的三功能NKp46×CD16 NK细胞衔接蛋白,目前由赛诺菲进行开发。此次公布的初步数据显示,SAR'579的耐受性良好,并在1 mg/kg的最高剂量下使8名复发/难治性急性髓性白血病患者中的3名患者达到了CR。
SNIPR001:公布1期临床试验的中期数据
SNIPR Biome公司公布了其首个CRISPR武装噬菌体疗法SNIPR001在健康受试者中的积极早期临床结果。SNIPR001是4种CRISPR武装噬菌体的混合物,可选择性靶向并消除对氟喹诺酮类药物有耐药性的大肠杆菌,帮助癌症患者预防危及生命的血液感染。它可以单独使用或与氟喹诺酮联合使用作为去定植策略。此前,SNIPR001已被美国FDA授予快速通道资格。
此次公布的数据显示,口服给药SNIPR001超过7天,患者的耐受性依然良好,只有轻度至中度的副作用,并且没有停药。此外,SNIPR001治疗降低了肠道大肠杆菌的水平,并可以以剂量依赖的方式从治疗个体的粪便中回收。
BDC-1001:公布1期临床试验数据
Bolt Biotherapeutics公司公布了其抗体偶联免疫刺激(ISAC)候选药物BDC-1001针对表达HER2的实体瘤开展的剂量递增研究的积极结果。Bolt公司的ISAC由三个主要组成部分:靶向肿瘤抗体、稳定且不可降解的连接子(linker)、和用于激活患者先天免疫系统的专有免疫刺激剂。BDC-1001能够靶向HER2,其包含的免疫刺激剂旨在募集和激活骨髓细胞。激活的骨髓细胞将释放细胞因子和趋化因子,吸引其他免疫细胞并降低免疫反应激活阈值的化学信号,开始前馈循环。这将重新编程肿瘤微环境并引发针对肿瘤的适应性免疫反应,以达到为癌症患者提供持久缓解的目的。
此次公布的结果显示,BDC-1001无论是作为单一疗法还是与纳武利尤单抗联合使用均具有良好的耐受性。在可评估的HER2阳性肿瘤患者中,2期临床推荐剂量(RP2D)下,无论是单药治疗(2/7)还是与纳武利尤单抗联合治疗(2/7)的缓解率均为29%。Bolt公司计划将BDC-1001推进到乳腺癌、结直肠癌、子宫内膜癌和胃食管癌的2期研究。
CUE-101:公布1期临床试验的新数据
Cue Biopharma公司公布了基于IL-2的生物制品CUE-101与PD-1抑制剂帕博利珠单抗联用作为一线疗法治疗患有复发性/转移性HPV+头颈部鳞状细胞癌(HNSCC)的1期临床的新数据。截至2023年5月15日的数据,该联合疗法治疗的14名可评估患者中有9名表现出肿瘤消退,其中5名为确认的PR和3名为持久的疾病稳定(DSD),DSD患者中有2名的肿瘤负荷分别减少了18%和24%,并在继续治疗中;接受RP2D的患者目前100%存活;在三线及以上的患者中,中位总生存期(OS)接近14个月。此外,CUE-101继续显示出良好的耐受性。
XTX101:公布1期临床试验的初步数据
Xilio Therapeutics公司公布了其肿瘤选择性抗CTLA-4单克隆抗体XTX101在晚期实体瘤患者中的1期临床试验的初步数据。XTX101旨在将抗CTLA-4效应精准地限制在肿瘤内部,防止产生肿瘤外的外周效应。这一策略可能改善治疗指数,克服其他抗CTLA-4抗体在效力和耐受性上受到的限制。在临床前研究中,XTX101耐受性良好,并实现了强大的肿瘤生长抑制作用,包括通过肿瘤选择性免疫激活达到完全缓解。
此次公布的数据显示,在每六周一次的RP2D(150 mg)下初步观察到XTX101的安全性良好,并在1例PD-L1阴性的晚期非小细胞肺癌患者中观察到其令人鼓舞的初步抗肿瘤活性,该患者在接受治疗后第9周时观察到了PR。
si-544:公布1b期临床试验的初步数据
selectION公司公布了其候选药物si-544在轻度至重度特应性皮炎患者中的1b期试验数据。si-544是一种选择性优化的肽,可阻断离子通道Kv1.3。Kv1.3是一种参与效应记忆T(TEM)细胞激活和增殖的特殊离子通道。TEM细胞是许多自身免疫性疾病(如特应性皮炎、银屑病、类风湿性关节炎或多发性硬化)及某些罕见癌症(如淋巴瘤)的根源。
在临床前研究中,si-544表现出了良好的疗效。该候选疗法通过在功能上抑制和消除疾病特异性、慢性激活的TEM细胞,同时保持完全的免疫能力,有望解决重大的未竟医疗需求。在该1b期临床试验中,没有观察到si-544的剂量限制毒性或安全信号。
RLS-0071:公布1b期临床试验数据
ReAlta Life Sciences公司公布了其候选疗法RLS-0071的早期临床试验数据。RLS-0071是一种具有补体抑制剂和天然抗炎肽双重作用的药物,旨在治疗急性肺病和其他中性粒细胞介导的疾病。此次公布的数据显示,在通过吸入脂多糖(LPS)诱导产生短暂炎症反应的健康受试者中,RLS-0071显著抑制了中性粒细胞浸润和促炎细胞因子(如IL-1ß和IL-8)的产生。
DSP107:公布1期临床试验数据
KAHR Medical公司公布了其候选融合蛋白DSP107联合PD-L1抑制剂阿替利珠单抗治疗晚期实体肿瘤患者的1期研究的积极结果。DSP107靶向CD47和4-1BB,旨在激活先天免疫和适应性免疫以治疗实体肿瘤和血液肿瘤。此次公布的结果显示,最高剂量联合治疗组的疾病控制率(DCR)为57%(4/7),患者表现出持久的缓解。此外,该联合疗法的耐受性良好,没有剂量限制性毒性,也没有血液学或肝脏毒性。
AU-007:公布1/2期临床试验的初步数据
Aulos Bioscience公司公布了其通过计算设计的IgG1单克隆抗体AU-007针对实体肿瘤的1/2期临床试验的中期结果。AU-007对IL-2的CD25结合部分具有高度选择性,它的作用机制不同于任何其他正在开发中的IL-2疗法,它能够在防止IL-2(无论是外源性的还是由T效应细胞分泌的)与调节性T细胞上的三聚体受体结合的同时,仍允许IL-2与T效应细胞和NK细胞结合并使之扩增,从而增强了IL-2的抗肿瘤免疫作用。这种机制防止了其他基于IL-2的治疗引起的负反馈环路,并使免疫系统偏向于激活而不是抑制。AU-007还能够防止IL-2与血管和肺内皮上的三聚体受体结合,有望显著降低与高剂量IL-2治疗相关的血管泄漏综合征和肺水肿。
此次公布的数据表明,AU-007在无法切除的局部晚期或转移性癌症患者中耐受性良好。7名具有可用药效学数据的患者都显示出调节性T细胞和嗜酸性粒细胞持续减少的趋势。4名肿瘤可评估患者中的3名达到了SD的最佳反应,2名患者在数据截止日期前仍在接受治疗。
Imvotamab:IND申请获得FDA许可
Imvotamab是IGM Biosciences公司开发的靶向CD20和CD3的双特异性单克隆抗体T细胞结合剂。临床前研究表明,imvotamab可能具有优于IgG双特异性抗体的优势,例如当CD20表达水平较低时,imvotamab与CD20表达细胞的结合能力更强。该公司计划于2023年第3季度启动两项1b期临床试验,分别针对严重系统性红斑狼疮和严重类风湿性关节炎。
THE-630:公布1/2期临床试验的初步数据
Theseus Pharmaceuticals公司公布了其小分子KIT泛变体酪氨酸激酶抑制剂THE-630用于治疗对早期治疗耐药的晚期胃肠道间质瘤(GIST)患者的初步临床数据。结果显示,THE-630通过队列6(18 mg)展示了令人鼓舞的安全性,支持继续增加剂量。此外,THE-630降低了所有主要类别的KIT激活突变和耐药突变的等位基因频率,其方式与预测耐药试验(PRA)中观察到的临床前预测一致,包括剂量依赖性地有效减少13号外显子V654A突变,这是GIST中最常见的耐药突变。在队列4-6(9-18 mg)中接受治疗的9名可评估的患者中有8名达到SD的最佳反应,DCR为89%。
SY-5609:公布1/1b期临床试验数据
Syros Pharmaceuticals公司公布了其新型可口服的CDK7抑制剂SY-5609在晚期实体瘤中的早期临床试验数据。公开资料显示,SY-5609对CDK7具有更高的选择性和效力,因而成为Syros Pharmaceuticals公司优先开发的对象。此次公布的数据显示,SY-5609作为单一药物(10 mg,为单用的最大耐受剂量)和联合用药(4或5 mg加吉西他滨)时,观察到了令人鼓舞的临床活性。在三名具有特定实体瘤的可评估患者(包括一名胰腺导管腺癌患者)中,SY-5609单药治疗(10 mg)的疾病控制率(DCR)为100%,胰腺导管腺癌患者的肿瘤缩小了10%。在接受联合治疗的9名胰腺导管腺癌患者中,DCR为44%(4/9),与当前的标准二线治疗相当。
JNT-517:公布1a期临床试验的初步数据
Jnana Therapeutics公司公布了其潜在“first-in-class"口服小分子抑制剂JNT-517在健康受试者中的积极早期临床数据。JNT-517靶向苯丙氨酸转运体SLC6A19上的别构位点,旨在治疗苯丙酮尿症(PKU)患者,无论其年龄或基因型如何。PKU由苯丙氨酸羟化酶(PAH)缺乏引起。苯丙氨酸是存在于所有含蛋白质食物中的一种氨基酸,而PAH是分解苯丙氨酸所必需的酶。当PAH缺乏或功能缺陷时,苯丙氨酸将在血液中积累至异常高的毒性水平。如果不及时治疗可能导致进行性和严重的神经功能损伤和神经心理并发症。SLC6A19是一种转运蛋白,负责肾脏对苯丙氨酸的重吸收至血液中。JNT-517通过抑制SLC6A19来阻止阻止肾脏对苯丙氨酸的重吸收,提供了一种潜在疗法来降低血液苯丙氨酸水平。
此前,该候选疗法已获得了FDA授予的罕见儿科疾病认定。此次公布的结果显示,JNT-517在健康受试者中的安全性和耐受性良好,没有严重的不良事件。此外,JNT-517被证实能够抑制SLC6A19,并导致苯丙氨酸的排泄增加。
ADS051:公布1b期临床试验数据
Adiso Therapeutics公司公布了其口服中性粒细胞运输和激活小分子调节剂ADS051治疗中度至重度活动性溃疡性结肠炎(UC)患者的早期临床数据。ADS051是一种作用局限于肠道、全身暴露有限的疗法,能够解决中性粒细胞介导的组织损伤——这是UC的一种病理学标志。此次公布的结果显示,ADS051安全且耐受性良好,并显示出积极的药理活性信号。
AX-158:公布1期临床试验数据
Artax Biopharma公司公布了其潜在“first-in-class"的口服免疫调节剂AX-158用于治疗T细胞介导疾病的早期临床数据。Nck是一种能直接放大T细胞受体上T细胞信号的蛋白质,有助于治疗T细胞介导的疾病。AX-158是一种Nck SH3.1结构域抑制剂,可选择性地阻断Nck在T细胞中的作用。AX-158的免疫调节作用有助于免疫系统保持健康控制并消除T细胞介导疾病的潜在驱动因素。
临床前数据表明AX-158不具有免疫抑制作用,因此不会影响免疫系统对外来病原体和感染产生强烈反应的能力。此次公布的结果显示,AX-158在所有剂量下均具有良好的耐受性,其药代动力学特征和生物利用度数据支持其每日一次的口服给药方案。
CSTI-500:公布1期临床试验数据
ConSynance Therapeutics公司公布了其用于治疗Prader-Willi综合征的三重单胺再摄取抑制剂CSTI-500的积极1期临床试验数据。PWS是一种罕见的遗传性神经系统疾病,其许多症状是由下丘脑功能障碍引起的。下丘脑是大脑的一部分,它控制着睡眠-清醒状态的稳定性并能调节饥饿和饱腹感之间的平衡。下丘脑功能障碍会导致PWS患者的两个主要神经精神症状——脾气暴躁和食欲过盛。CSTI-500旨在以最佳比例调节血清素、多巴胺和去甲肾上腺素的再摄取——这三种重要的神经递质参与许多神经精神和神经功能,例如进食行为、情绪和睡眠,有望安全有效地减轻食欲过盛和脾气暴躁。
此次公布的数据显示,CSTI-500表现出很强的安全性,没有出现严重的不良事件。此外,其药代动力学结果与早期在健康受试者中的观察结果非常吻合。目前,CSTI-500正准备进入2期临床试验。




