转自:药时空
2023年5月25日,美国食品和药品监督管理局 (FDA) 正式批准了辉瑞(Pfizer)的口服抗新冠病毒药物 Paxlovid 用于治疗成人患者的轻至中度 COVID-19 感染者。这些患者处于严重 COVID-19 进展的高风险之中 ,如果放任进展他们很有可能会入院乃至死亡。
Paxlovid 是 FDA 批准的第四种用于治疗成人 COVID-19 的药物,也是唯一一款口服抗病毒药,由 Nirmatrelvir 和 Ritonavir 两种药物组合而成的口服制剂。
根据紧急使用授权 (EUA) 生产的、由美国卫生与公共服务部分配的 Paxlovid,将继续提供给成年患者,并确保对符合条件的 12-18岁的儿童进行治疗。不过,儿童并未被纳入此次的批准范围。此外,Paxlovid 未被批准或授权作为预防 COVID-19 的前暴露或后暴露的保护药剂。
FDA 中心主任 Patrizia Cavazzoni 博士表示:尽管疫情对我们所有人来说都是挑战,但我们已经取得了很大进展,减轻了COVID-19对我们生活的影响。此次的批准表明,Paxlovid 已达到 FDA 对药物安全性和有效性的严格标准,将是高风险人群的重要治疗选择。FDA 致力于与研发机构合作,促进 COVID-19 相关的新的预防和治疗方案的开发。
根据《美国联邦食品、药品和化妆品法》,批准一种新药需要大量的证据证明其有效性和安全性。在考虑批准一种新药时,FDA 会基于严格的科学标准进行受益风险评估,以确保药物的好处大于其预期人群的实际风险。
Paxlovid 的有效性主要得到了 EPIC-HR 临床试验的最终结果支持。
EPIC-HR 是一项随机、双盲、安慰剂对照的临床试验,旨在研究 Paxlovid 对非住院症状明显的成年患者 (18岁及以上) 的治疗作用。入组受试群体已经通过实验室确认了 SARS-CoV-2 病毒的感染。患者是具有特定严重疾病进展风险因素的18岁及以上成年人,或者 60岁及以上无论是否存在慢性病史。所有患者都没有接种 COVID-19 疫苗,也没有在先前感染过 COVID-19。
EPIC-HR 试验结果表明,感染者在感染五天之内接受 Paxlovid 治疗,能够将 COVID-19 导致的住院或死亡相关的比例降低 86%!事实上,在感染之后的 28天跟踪观察期间内,Paxlovid 可将持续减少 86%。在这项研究中,共有 977名高风险感染者接受了 Paxlovid 治疗,同时有 989名感染者接受了安慰剂。
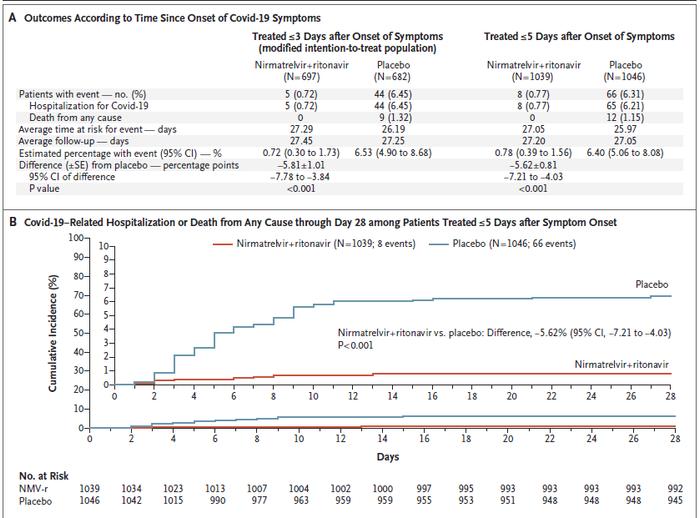
▲ NJEM 论文:DOI: 10.1056/NEJMoa2118542
在Paxlovid 治疗组中,仅有 0.9%的感染者因 COVID-19 而导致住院或死亡。相比之下,安慰剂组中有 6.5%的感染者在 28天的随访期间加重到住院或死亡的程度。
Paxlovid 的效果在已对 COVID-19 形成免疫力的患者身上也得到了验证。在 EPIC-HR 试验中的抗体阳性患者中,接受 Paxlovid 治疗的患者在 28天内因任何原因而导致 COVID-19 相关的住院或死亡的风险为 0.2%,而接受安慰剂治疗的患者的风险为 1.7%。EPIC-SR 是一项将接种了至少一种 COVID-19 风险因素的成年患者纳入研究的临床试验。虽然未具统计学意义,但在接种了疫苗并具有至少一种风险因素的接种者中,COVID-19 相关的住院或死亡的风险也有所降低。
EPIC-HR 和 EPIC-SR 这两项随机对照试验,还提供了有关 COVID-19 反弹的信息。来自这两项试验的数据表明,SARS-CoV-2 (RNA 或 病毒) 脱落或 COVID-19 症状在患者中只有极小部分出现反弹,而且在接受 Paxlovid 治疗和接受安慰剂治疗的患者中都有发生。根据目前研究结构提供给 FDA 的数据,目前还没有明确的证据表明 Paxlovid 治疗与 COVID-19 反弹之间存在关联。

