转自:一度医药
3月20日,第一三共在日本肿瘤内科学会年会的两次主席会议上,发布了patritumab deruxtecan(HER3-DXd)两项早期试验的数据更新。其中一项针对EGFR突变转移性非小细胞肺癌(NSCLC)患者;另一项针对Her3表达转移性乳腺癌患者。

两项试验的入组患者大都已经接受过大量的治疗,迫切需要新的治疗方法。
Patritumab Deruxtecan(HER3- dxd)是一款在研靶向HER3的ADC,采用第一三共专有的DXd ADC技术设计,由人源化抗HER3单克隆抗体,通过稳定、可裂解的四肽连接子与高效载荷拓扑异构酶I抑制剂DXd共价结合。
Patritumab Deruxtecan于2021年12月被FDA授予突破性疗法认定(BTD),用于治疗在接受第三代TKI和以铂为基础的疗法治疗时或治疗后出现疾病进展的转移性或局部晚期EGFR突变NSCLC患者。
1
EGFR突变NSCLC 1期试验结果
来自HER3-DXd(5.6 mg/kg) 1期临床试验汇总分析的最新数据,包括首次公布的经重度预处理的EGFR突变局部晚期或转移性NSCLC患者的结果显示,在中位随访23个月(范围,11.8-36.0)后显示出积极的临床疗效。
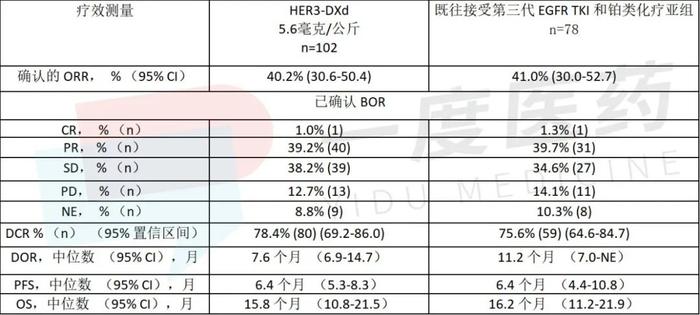
在对102例EGFR突变NSCLC患者的汇总分析中,HER3-DXd的客观缓解率(ORR)为40.2% (95% CI: 30.6-50.4)。其中,1例完全缓解(CR)、40例部分缓解(PRs),39例病情稳定(SD)。疾病控制率(DCR)为78.4% (95% CI: 69.2-86.0),中位缓解持续时间(DOR)为7.6个月(95% CI: 6.9-14.7)。中位无进展生存期(PFS)为6.4个月(95% CI: 5.3-8.3),中位总生存期(OS)为15.8个月(95% CI: 10.8-21.5)。在先前接受第三代EGFR TKI和铂类化疗的78例患者的亚组中,疗效结果一致。
在HER3广泛表达和EGFR TKI耐药的多种机制的患者中,使用HER3-DXd均出现了反应。此外,在有和没有中枢神经系统(CNS)转移史的患者中,ORR分别为36.4% (95% CI: 23.8-50.4)和44.7% (95% CI: 30.2-59.9)。
日本大阪近畿大学肿瘤内科副教授Hidetoshi Hayashi表示,HER3-DXd显示出超过15个月的中位总生存期,这对于局部晚期或转移性EGFR突变非小细胞肺癌的重度预处理患者很难得。HER3-DXd在EGFR突变NSCLC中的进一步临床评估正在进行中。
接受了中位4线既往全身治疗(范围,1-14)局部晚期/转移性患者接受HER3-DXd中位治疗持续时间为5.5个月(范围,0.7-27.5)。在这项1期试验中HER3-DXd的安全性与之前在EGFR突变的NSCLC患者中观察到的安全性一致。报告紧急不良事件(TEAEs)≥3级的患者为58例(56.9%),包括血小板计数下降(26%)、中性粒细胞计数下降(21%)、疲劳(10%)、贫血(9%)、白细胞计数下降(8%)、恶心(7%)、低钾血症(7%)、淋巴细胞计数下降(7%)、呼吸困难(6%)和发热性中性粒细胞减少(6%)。8位患者(7.8%)经独立评审委员会确认出现与治疗相关的间质性肺病(ILD)。这些ILD事件以低级别为主,有2项1级、3项2级、1项3级和2项5级。截至2022年1月28日数据截点,8名患者仍在接受HER3-DXd的研究治疗。
EGFR突变NSCLC 1期试验结果摘要
2
HER3表达转移性乳腺癌1/2期临床试验
新披露的HER2表达(HER2低定义为IHC 1+或IHC2+/ISH-;或HER2 0)探索性亚组(n=182)分析显示出了有前景的临床活性。该数据来自一项由三部分组成的首次人体1/2期试验,该试验评估了HER3-DXd治疗重度预处理的HER3表达转移性乳腺癌患者,包括HR阳性/HER2阴性和三阴乳腺癌(TNBC)。
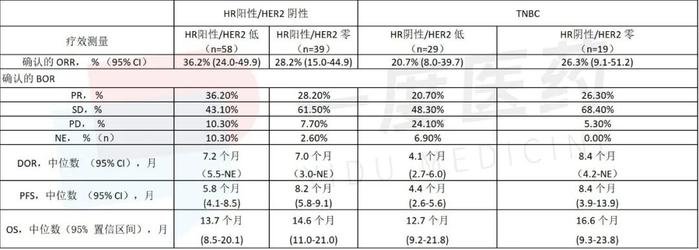
在HR阳性乳腺癌患者中,HER2低(n=58)患者中ORR为36.2% (95% CI: 24.0-49.9),在HER2为0(n=39)患者中ORR为28.2% (95% CI: 15.0-44.9)。在HER2低和HER2为0亚组中,中位DOR分别为7.2个月(95% CI: 5.5-NE)和7.0个月(95% CI: 3.0-NE),中位PFS分别为5.8个月(95% CI: 4.1-8.5)和8.2个月(95% CI: 5.8-9.1),中位OS分别为13.7个月(95% CI: 8.5-20.1)和14.6个月(95% CI: 11.0-21.0)。
在TNBC患者中,HER2低表达患者(n=29)ORR为20.7% (95% CI: 8.0-39.7), HER2零表达患者(n=19)ORR为26.3% (95% CI: 9.1-51.2)。在HER2低和HER2零亚组中,中位DOR分别为4.1个月(95% CI: 2.7-6.0)和8.4个月(95% CI: 4.2-NE),中位PFS分别为4.4个月(95% CI: 2.6-5.6)和8.4个月(95% CI: 3.9-13.9), OS分别为12.7个月(95% CI: 9.2-21.8)和16.6个月(95% CI: 9.3-23.8)。
本次进一步分析了HER3-DXd安全性剂量(4.8 mg/kg和6.4 mg/kg),日本(n=142)或美国(n=40)亚组之间TEAE的总体比例相似(不包括ILD)。TEAE≥3级在日本发生99例(69.7%),在美国发生21例(52.5%)。独立评审委员会确定,12例来自日本的患者(8.5%)出现与治疗相关的ILD,0例来自美国的患者确认ILD。大部分ILD事件为低级别事件,其中1级事件3起(2.1%),2级事件5起(3.5%),3级事件3起(2.1%),5级事件1起(0.7%)。
日本名古屋爱知癌症中心医院副主任兼乳腺肿瘤科主任Hiroji Iwata表示,这些数据扩展了之前的观察,并表明HER3-DXd在转移性乳腺癌和HER2低表达或HER2零表达患者中显示出临床活性。
各亚组的患者都接受了大量预处理,HR阳性、HER2低和HER2零亚组的中位既往全身治疗为7线,HR阴性、HER2低亚组的既往全身治疗为4线,HR阴性、HER2零亚组的既往全身治疗为3线。中位治疗时间在HR阳性、HER2低亚组为5.5个月(范围,0.7-28.4),HR阳性、HER2零亚组为7.6个月(范围,1.4-22.8),HR阴性、HER2低亚组为4.9个月(范围,0.7-19.8),HR阴性、HER2零亚组为5.7个月(范围,0.7-22.5)。截至2021年8月16日数据截点,四名患者(10.6%)仍在接受HER3-DXd治疗。
HER2表达转移性乳腺癌3/1期试验中HER2表达亚组分析摘要
►5款重磅ADC
第一三共的DXd ADC管线目前包含5个产品,正进行多种癌症的临床开发。首先是靶向HER2的重磅ADC ENHERTU以及靶向TROP2的datopotamab deruxtecan (Dato-DXd),以上两款ADC由第一三共与阿斯利康在全球开发和商业化。
此外有本次披露临床更新靶向HER3的 patritumab deruxtecan (HER3- Dxd)。
另外两款包括:ifinatamab deruxtecan (I-DXd;DS-7300)靶向B7-H3;DS-6000靶向CDH6,正通过与Sarah Cannon research Institute的早期战略研究协议合作开发。
作者:Tim
主编:Mars

