转自:注册圈
- ICH《M10:生物分析方法验证和研究样品分析》问答文件、常见问题解答文件实施建议和中文版意见
- 《阿片类口服固体仿制药防滥用药学研究技术指导原则(试行)》
- 《药物临床试验期间安全性数据快速报告常见问答(2.0版)》
- 《药物临床试验期间安全性信息汇总分析和报告指导原则(试行)》
- 《化药复方药物临床试验技术指导原则》
NO.1

为推动新修订的ICH指导原则在国内的平稳落地实施,我中心拟定了《
如有修改意见,请反馈至联系人电子邮箱:gkzhqyj@cde.org.cn。
2. M10问答文件中文版
3. M10问答文件英文版
4.M10常见问题解答文件中文版
5. M10常见问题解答文件英文版
国家药品监督管理局药品审评中心
2023年3月17日
NO.2

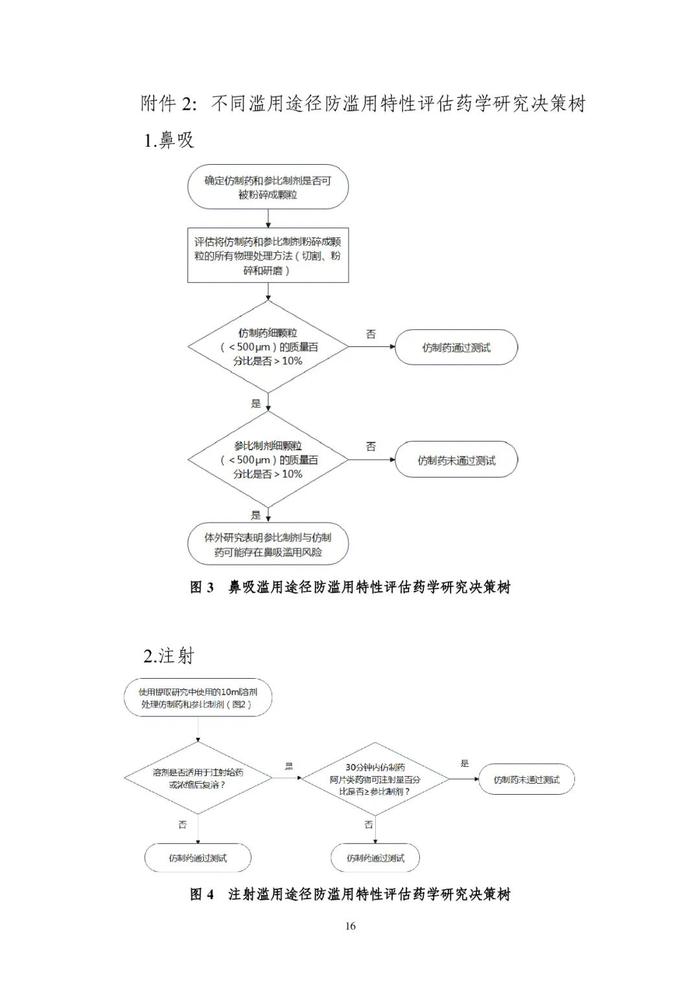
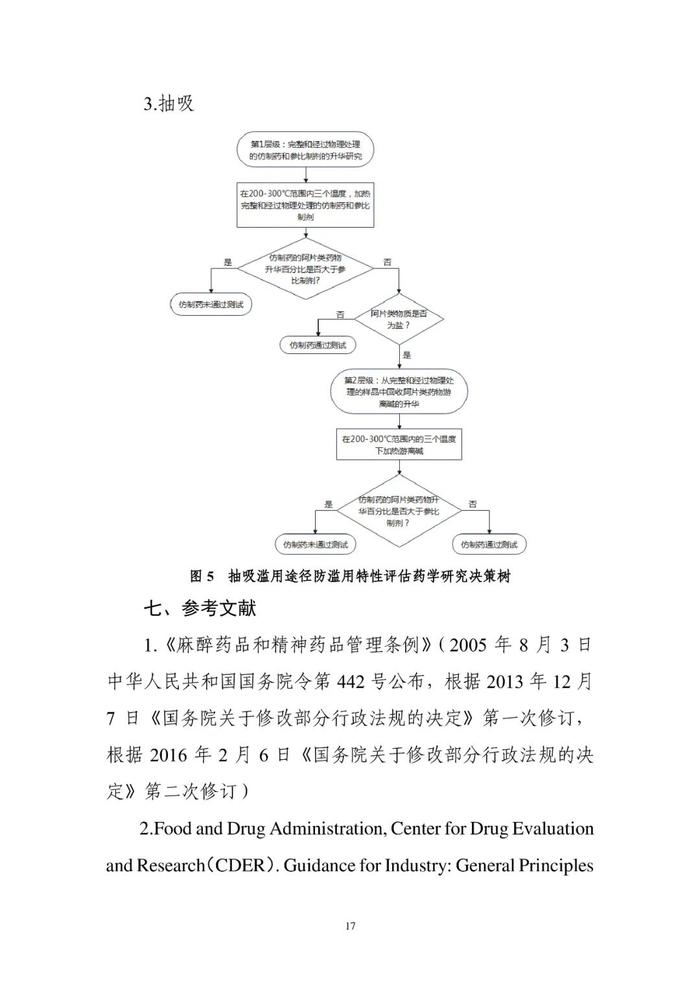
阿片类药物的滥用已在全球范围内成为日益严重的公共卫生问题。为鼓励开发具有防滥用特性的阿片类口服固体仿制药,提供研究与评价的药学技术标准,在国家药品监督管理局的部署下,药审中心组织制定了《阿片类口服固体仿制药防滥用药学研究技术指导原则(试行)》(见附件)。
根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
特此通告。
国家药监局药审中心
2023年3月16日
NO.3

为进一步推动ICH E2A、E2B(R3)及区域实施指南落地实施,促进药物临床试验期间安全性数据快速报告标准统一,提升数据质量,在国家药品监督管理局的部署下,药审中心组织制定了《药物临床试验期间安全性数据快速报告常见问答(2.0版)》(见附件)。
根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。《药物临床试验期间安全性数据快速报告常见问答(1.0版)》同时废止。
特此通告。
国家药监局药审中心
2023年3月17日
NO.4

根据现行《药品注册管理办法》《药物临床试验质量管理规范》和《药物警戒质量管理规范》,为推进临床试验期间安全信息汇总分析与风险评估工作,在国家药品监督管理局的部署下,药审中心组织制定了《药物临床试验期间安全性信息汇总分析和报告指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
特此通告。
国家药监局药审中心
2023年3月17日
NO.5

复方药物是指含有两种或两种以上活性成份的药物,其临床研发具有特殊性。为了科学引导企业合理开发复方药物,进一步明确技术标准,药审中心组织制定了《化药复方药物临床试验技术指导原则》(见附件)。
根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
特此通告。
国家药监局药审中心
2023年3月17日