转自:药渡
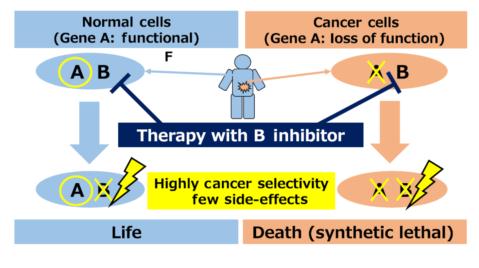
1922年,哥伦比亚大学摩尔根实验室的遗传学家Calvin Bridges,在黑腹果蝇身上发现一种有趣的现象:当某两个特定的基因同时突变失活时,会导致果蝇的死亡;而这两个基因单独任何一个突变失活,都不会给果蝇带来致命的伤害。1946年,Theodosius Dobzhansky给这种现象取了个名字—— “合成致死”效应。
所谓“合成致死”,就是对于细胞中的两个基因,其中任何一个单独突变或者不发挥作用时,都不会导致细胞死亡;而两者同时突变或者不能表达时,就会导致细胞死亡,利用该原理可实现选择性杀伤肿瘤细胞而不对正常体细胞产生影响。
基于合成致死原理的肿瘤治疗
尽管如今“合成致死”的概念已蓬勃发展,成为新兴热门赛道。但是其发展经历了漫长的过程。2014年,全球首款“合成致死”理念相关药物PARP(多聚ADP核糖聚合酶)抑制剂Olaparib,获FDA批准用于治疗卵巢癌。自此,“合成致死”由概念变成现实。
如今,国内外大量资源投入到“合成致死”研究中,除了PARP外,PRMT5、WEE1、ATR、ATM等靶点的研究也逐渐展露头角,它们的研究进展到哪一步了呢?
PRMT5抑制剂
PRMT(蛋白质精氨酸甲基转移酶)能够使多种蛋白甲基化,并在基因表达、剪接和DNA损伤修复等生物学过程中发挥重要作用。在哺乳动物中,共有9种PRMTs, 分为I、II、III三种类型。其中I型包括PRMT1、2、3、4、6、8,主要催化生成单甲基精氨酸(MMA)和不对称二甲基精氨酸(ADMA);Ⅱ型包括PRMT5、9,主要催化生成MMA和对称二甲基精氨酸(SDMA);III型包括PRMT7,主要催化生成MMA。其中PRMT5是关注度最高的一种亚型。
PRMT5通过对称二甲基化,翻译后修饰组蛋白和其他蛋白质;这种由PRMT5催化的蛋白质底物甲基化在调节关键细胞进程中起着重要作用,如DNA修复、细胞周期进展、转录调控和RNA剪接等。PRMT5被认为是一种潜在的致癌基因。
PRMT5作用机制
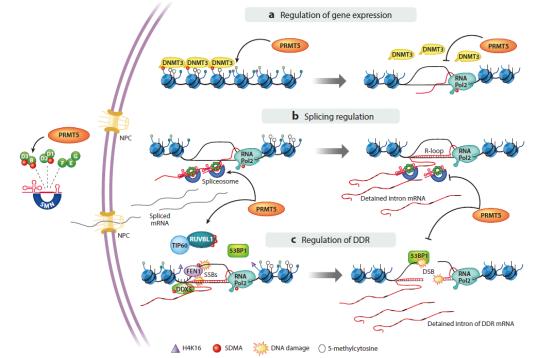
2016年,发表在《Science》的文章首次报道了抑制PRMT5在MTAP(甲硫腺苷磷酸化酶)缺失肿瘤中的“合成致死”效应,文章指出与PRMT5构成合成致死的基因是MTAP,这是一种抑癌基因,常在肿瘤中发生缺失。因此,PRMT5/MTAP抑制剂被认为是潜在的抗肿瘤药物。目前,大约有十几款PRMT5抑制剂已进入临床阶段。
全球部分在研PRMT5抑制剂
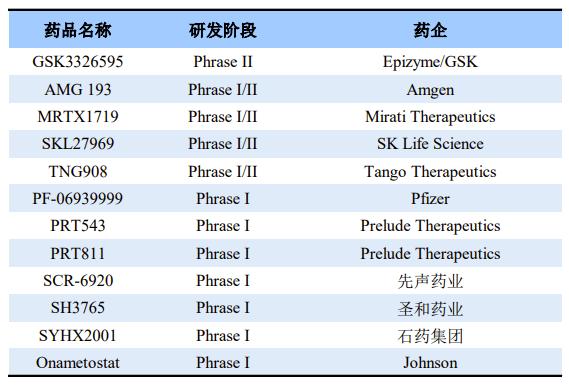
其中,Epizyme和GSK共同研发的GSK3326595是目前进展最快的PRMT5选择性小分子抑制剂。它带有一个四氢异喹啉片段(THIQ),THIQ环与PRMT5特有的残基Phe327形成潜在的π-π堆积作用,可有效抑制肿瘤体积。另外,GSK3326595具有良好的脑通透性和抗肿瘤效果。
WEE1抑制剂
Wee1激酶最早发现于裂殖酵母中,是丝氨酸/苏氨酸蛋白激酶家族的重要成员之一。它是一种高度保守的细胞周期调节蛋白,主要由3个结构域组成,即N-端结构域、中心激酶结构域和1个短的C-端结构域。N-端结构域是Wee1激酶的激活结构域,也是抑制周期蛋白依赖性激酶1-周期蛋白B(CDK1-CyclinB)复合物去磷酸化的潜在位点,这些泛素化识别位点可以严格控制Wee1的细胞内半衰期;C-端结构域主要包含催化段和活化段。
Wee1激酶作用机制
Wee1激酶可通过磷酸化CDK的Thr14和Tyr15位点来抑制CDK激酶的活性,进而抑制细胞进入有丝分裂。与Wee1 形成合成致死效应的搭档是TP53。该基因翻译的P53蛋白是细胞生长、增殖和损伤修复的重要调节因子。正常情况下,当细胞的DNA受损时,P53蛋白会阻止细胞增殖而停止于G1/S期,直到损伤修复好后才能进入G2期,如不能修复则促进细胞凋亡。因此,TP53属于抑癌基因,在多种恶性肿瘤中会发生TP53突变。
由于TP53突变在多种癌症中普遍存在,因此Wee1抑制剂具有巨大的市场潜力,目前在研的Wee1药物有十余种。
全球部分在研Wee1抑制剂
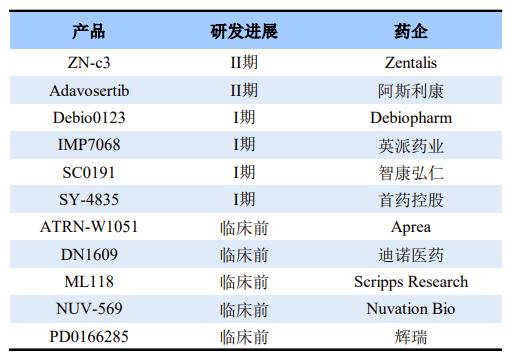
在全球Wee1抑制剂研发进展中,Zentalis的ZN-c3进展最快。ZN-c3由Zentails公司开发,是一款治疗晚期实体瘤的Wee1口服抑制剂。它能使癌细胞在不修复DNA损伤的情况下进行有丝分裂,导致有丝分裂提前进行,造成癌细胞凋亡。
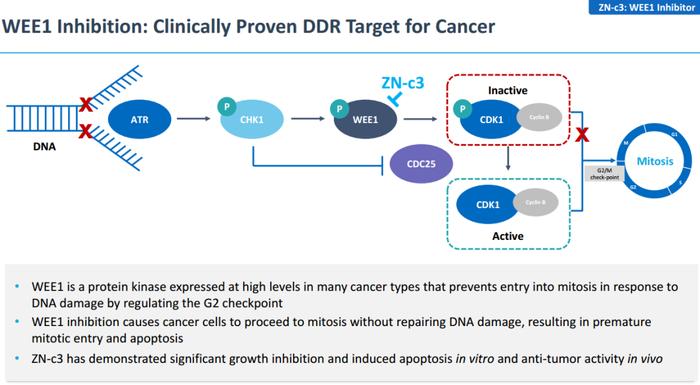
ZN-c3作用机制
ZN-c3已在单药和联合用药中展现出广泛疗效。与单药治疗相比,Wee1和PARP抑制剂联合用药具有更强的抗肿瘤能力。Wee1抑制剂加吉西他滨治疗铂类难治性复发性卵巢癌、单药治疗复发性或持续性子宫浆液性癌均取得较好的抗肿瘤效果。
在国内Wee1抑制剂研发上,布局的企业仍只是少数,仅有英派药业、智康弘仁、首药控股等。
ATR抑制剂
ATR全称共济失调毛细血管扩张突变基因Rad3相关激酶,是一种在DNA损伤后能够激活细胞应答,进而阻滞细胞周期进程并稳定复制叉及修复DNA,从而回避细胞凋亡的重要激酶。当细胞内DNA复制压力、DNA损伤产生时,ATR被募集至DNA损伤部位,多种蛋白参与调控ATR的激活。当ATR激活后,可通过多种信号调控细胞生物过程,包括细胞周期阻滞、抑制复制起点、启动复制叉以及修复DNA双链断裂等。
ATR作用机制
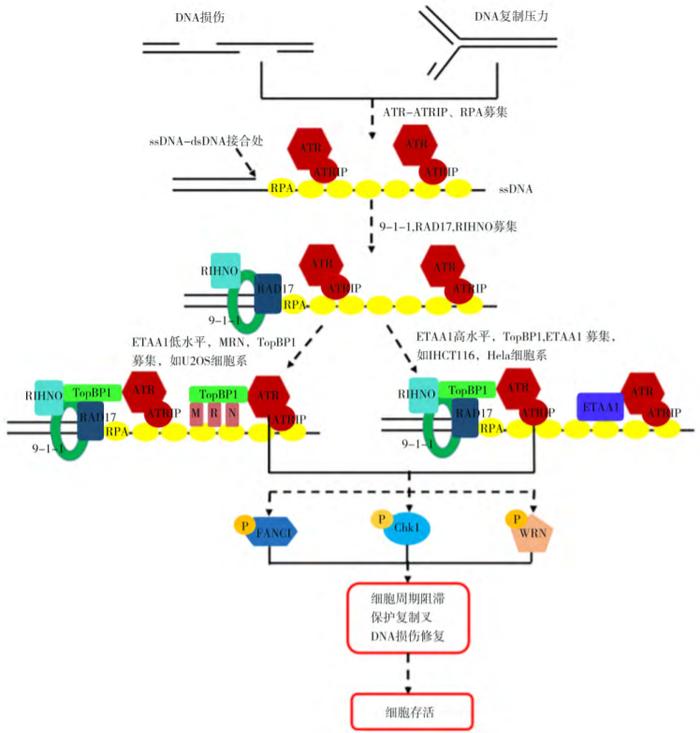
由于肿瘤细胞的多种DNA修复通路存在缺陷,因此相对于正常细胞,肿瘤细胞更依赖ATR修复通路并对ATR抑制剂更加敏感。因此ATR抑制剂凭借选择性影响肿瘤细胞、而对正常细胞影响较小的优势,有望成为肿瘤治疗的优异潜在药物。ATR抑制剂赛道吸引了一批跨国药企入局,目前全球已有多款ATR抑制剂处于临床阶段。
全球部分在研ATR抑制剂
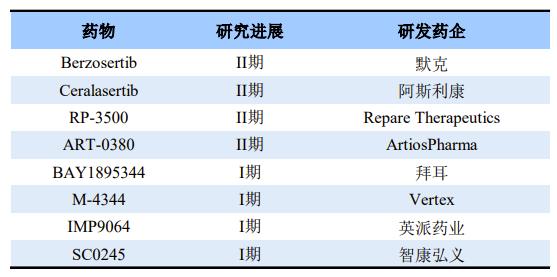
Berzosertib是全球首款进入临床试验的ATR 激酶抑制剂。此前,由美国国家癌症研究所(NCI)开展的一项II期概念验证性研究的结果证实,Berzosertib联合拓扑替康(一种化疗药物)治疗复发性小细胞肺癌(SCLC)患者疗效显著,客观缓解率(ORR)达36%(n=9/25),试验达到主要疗效终点。而且在铂耐药患者中,大部分患者表现出持久的缓解(通常情况下铂耐药患者会在复发的数周内死亡)。
目前国内布局ATR抑制剂的企业仍较少,进入临床阶段的仅有英派药业和智康弘义。
ATM抑制剂
ATM是PIKK家族的成员,主要参与对DNA双链断裂(DSB)的反应。ATM 有五个主要的自磷酸化位点:Ser367,Ser1893,Ser1981、Ser2996 和 Thr1885。正常状态下,ATM以二聚体的状态存在,当ATM 受到 DNA 损伤的刺激,其二聚体形式就会解离并转化为单体,导致上述残基(自磷酸化位点)的磷酸化。
ATM的下游通路
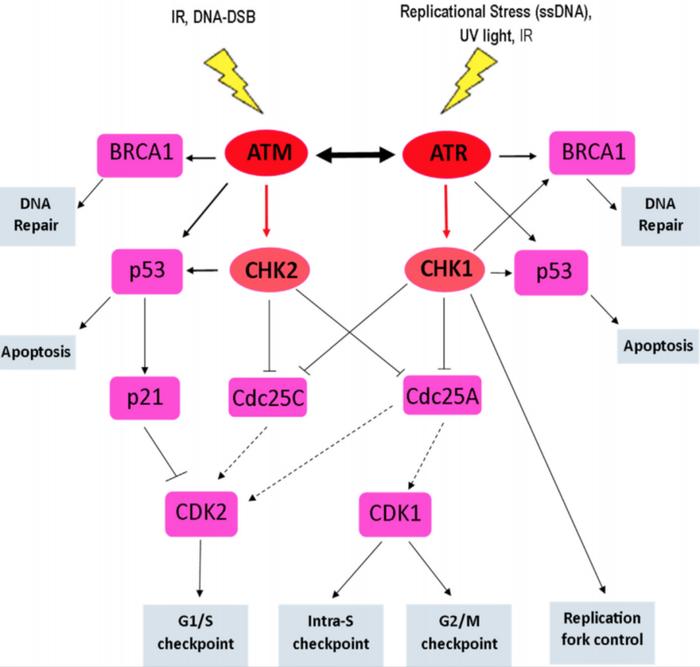
来源:Progress towards a clinically-successful ATR inhibitor for cancer therapy
ATM磷酸化后,会相继调控其他激酶活性,如细胞周期检测点激酶2(CHK2);另P53曾经被用作ATM活化的标记物,其作用机制也被广泛研究。目前ATM抑制剂均处于临床早期阶段,仅有4款处于临床I期,分别是:阿斯利康的AZD-1390、默克的M-4076、XRadTherapeutics的XRD-0394,威尚生物的WSD0628。
全球部分在研ATM抑制剂
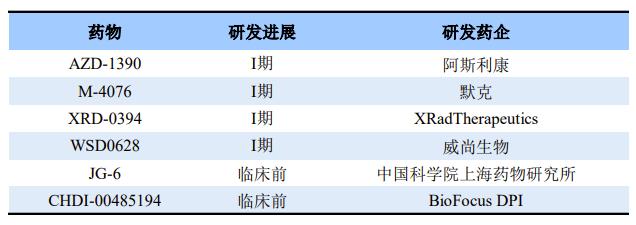
今年1月18日,威尚生物宣布其创新药物WSD0628获FDA批准在美国开展临床试验。WSD0628是一款能穿透血脑屏障的ATM靶向抑制剂,拟开发联合放疗作为放疗增敏剂用于脑胶质母细胞瘤、间变型胶质瘤以及其他肿瘤的神经中枢转移。
“合成致死”疗法为原本只能针对1个靶点的小分子靶向治疗打开了无限想象空间。这既有潜力针对部分传统上不可成药的常见致癌基因;又能克服由常规靶向疗法耐药突变的一些情况;此外,还可通过联合用药,造成主动合成致死的情况。可以说,合成致死作为肿瘤治疗的新兴领域,前途无限。当前,合成致死领域商业化成功运作的只有PARP抑制剂,也是竞争激烈的赛道。与其在PARP抑制剂这片红海中内卷,不如转而尝试以上刚刚崭露头角的靶点,寻找适合自己的差异化破局之道。
参考来源
Yuanxiang Wang et al; Protein Arginine Methyltransferase 5 (PRMT5) as an Anticancer Target and ItsInhibitor Discovery; J. Med. Chem. 2018, 61, 9429−9441;
Yudao shen et al; Discovery of First-in-Class Protein Arginine Methyltransferase 5 (PRMT5) Degraders; J. Med. Chem. 2020, 63, 9977−9989;
Genetic control of cell size at cell division in yeast[J]. Nature, 1975, 256(5518): 547-551;
Nijman S M, Friend S H. Potential of the Synthetic Lethality Principle[J]. Science, 2013, 342(6160): 809-811. DOI:10.1126/science.1244669;
《“合成致死”赛道风再起,ATR抑制剂会是下一片蓝海?》,免疫时间,2022-06-06。





举报成功