转自:药明康德
过去4年里,FDA批准了8款抗体偶联药物(ADC),超过此前批准ADC的总和。这些抗体偶联药物的突破离不开对ADC载荷和连接子设计的不断创新。日前,普众发现(Multitude Therapeutics)公司科学家领衔的研究团队发表论文,描述了一种将新型拓扑异构酶1(TOP1)抑制剂载荷连接到单克隆抗体表面的方法。这一新技术有望在提高ADC效力,克服肿瘤耐药性的同时,不增加药物毒副作用,为目前ADC治疗选择尚未触达的患者造福。

近年来ADC设计上的突破之一是使用TOP1抑制剂作为载荷。它们虽然毒杀细胞的效力比微管抑制剂低,但是更为安全并且具有旁观者杀伤效应。基于这类载荷开发的ADC药物Enhertu和Trodelvy已经获得FDA的批准上市。
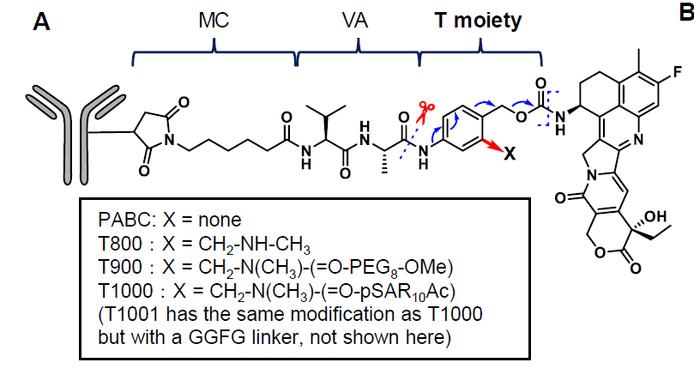
不过,由于肿瘤异质性和多重耐药机制,基于现有TOP1抑制剂载荷DXd和SN-38的ADC在临床研究中的缓解率有限。Exatecan是DXd的前体,它具有更高的TOP1抑制效力,更好的渗透性和旁观者杀伤效应。然而,exatecan本身的疏水性很强,不能直接偶联在单克隆抗体上。
在这篇论文中,研究团队对exatecan和DXd/SN-38作为ADC载荷进行了系统性的比较,开发出一种名为“T moiety”的创新化学,在掩盖exatecan的疏水性同时,允许使用临床验证的连接子将它偶联在单克隆抗体上。
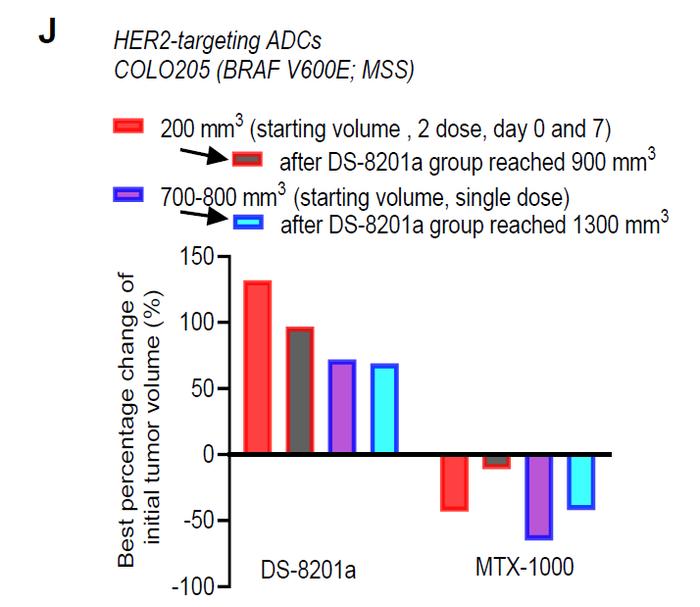
实验结果显示,利用这一技术将exatecan偶联在抗体上产生的ADC(MTX-1000),与基于DXd/SN-38的ADC相比,获得更好的治疗指数,并且肿瘤内药效学特征得到改善。这些改善导致MTX-1000在治疗靶点蛋白表达水平低,肿瘤体积大,或者对DXd/SN-38为载荷的ADC产生耐药性的肿瘤时,表现出更好的抗肿瘤效力。
此外,研究还显示,MTX-1000在结肠癌和肺癌模型中均能够克服肿瘤的耐药性。它还与PARP/ATR抑制剂和抗PD-1抗体疗法具有协同作用。在非人灵长类的动物实验中,这类新型ADC并未表现出更高的毒副作用。
研究人员表示,这一研究构建了以exatecan为载荷的ADC药物系列,它们具有更好的效力,可以克服针对ADC药物的重要耐药机制,并且未表现出更强的毒副作用,具有临床转化潜力,解决目前ADC尚未满足的未竟患者需求。而且,T moiety技术的灵活性和可扩展性可以促进引入具有不同作用机制的载荷,解决耐药性的持续挑战。
参考资料:
[1] Weng et al., (2023). Antibody-exatecan conjugates with a novel self-immolative moiety overcome resistance in colon and lung cancer. Cancer Discovery, https://doi.org/10.1158/2159-8290.CD-22-1368
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。




举报成功