编者按:城市是人类文明的标志。怀着“城市让生活更美好”的共同愿景,越来越多的人居住在城市中,共同创造着城市的繁荣、健康和人类的福祉。中科院之声和城市环境研究所联合开设“你我的城”专栏,讲述你我的行为如何塑造了城市环境,城市环境又如何影响了你我的健康、动物的健康以及生态系统的健康。
深藏不露的”狠角色”
提到寄生虫,我们往往会“谈虫色变”,立刻想起导致营养不良的蛔虫、弓形虫,或者猪肉中的小白颗粒,还有传播致命疾病的跳蚤和蚊虫等。因此,寄生虫往往被认为是有害的,是需要消灭和控制的“敌人”。实际上,寄生虫在自然界中扮演着非常重要的角色,且“分量十足”。
寄生虫的物种数量之多远超我们的想象。据估算,在地球上随机抽取10个物种,过半数都是寄生生物。尽管寄生虫体型细小,但其生物量不容忽视。在河口系统中,寄生虫的生物量甚至超过全部鸟类的生物量之和。在土壤中,无脊椎动物的寄生虫——顶复门(Apicomplexa)是土壤中最具优势的微生物类群之一。因此,与自由生活的植物、动物和微生物一样,寄生虫是自然界最基础的组成部分。
▲图1 寄生虫的生物多样性 图片来源:https://www.newyorker.com/magazine/2022/12/12/in-praise-of-parasites
自然界生态和进化过程的调控者
很多自然过程和现象与寄生虫息息相关。例如,“寄生恶魔”铁线虫(Nematomorpha)的幼虫寄生在蚱蜢和螳螂体内(图2)。为完成生命周期,幼虫会操控宿主行为,使其跳入水中。每年“跳河轻生”的昆虫数量之大,可占某些鱼类食物的6成以上。

▲图2 “寄生恶魔”铁线虫寄生
在北美洲,帝王蝶(Danaus plexippus L.)的长途迁徙是著名的自然奇观之一(图3)。研究发现,迁徙的蝶群中寄生虫数量远低于不迁徙的蝶群,这表明迁徙行为可能是为了逃避寄生虫而进化出来的适应策略。此外,寄生虫还可以帮助宿主抵抗其他病原,抑制优势动物类群过度增长,以此保持自然平衡,调节食物网能量物质流动等。可以说,寄生虫在自然界中参与了几乎所有的生态和进化过程。

▲图3 帝王蝶万里迁徙 图片来源:科学网徐令予博客
全球变化下的生态挑战
寄生虫对宿主高度依赖,但宿主范围狭窄,这造成寄生虫对环境变化相当敏感。目前,人类活动和气候变化已经对寄生虫多样性产生严重影响。最近,一项在中国大尺度范围内进行的调查发现,城市和农业用地中寄生虫的物种数目比自然森林低20-70%,这与动物宿主的物种丧失和环境变化(干旱、高温和直接光照)密切相关(图4)。
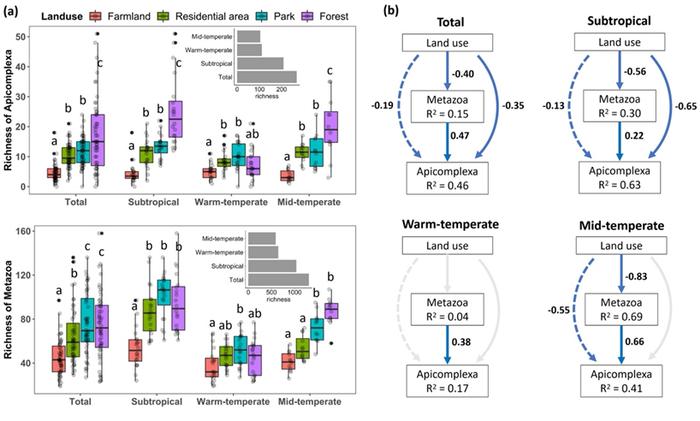
▲图4 不同土地利用类型和不同气候区域中顶复门和后生动物的OTU丰富度的变化(a);土地利用强度对顶复门类群丰富度的级联和非级联效应(b)
基于寄生虫的脆弱性以及全球环境的急速变化,二十多年前,已经相继有人提倡保护寄生虫的多样性,并将寄生虫多样性作为环境健康的指标。近年来,科学家可以高效且低成本地评估寄生虫群落及其多样性,为寄生虫的研究和保护提供了新的动力,这也符合当下生物多样性保护的一个重要范式转变——从保护具体的物种或特定类群,延伸到对其共生体的保护。
展望
寄生虫与宿主之间的复杂关系及其对全球变化因素的响应仍然存在许多未解之谜。未来,我们应该加强对寄生虫多样性的研究,深入了解寄生虫多样性,这将有助于我们理解生物多样性的整体平衡维持机制,对于保护人类自身的健康和维护生态系统的稳定也具有重要意义。
参考文献:
1. Dougherty, E. R., Carlson, C. J., Bueno, V. M., Burgio, K. R., Cizauskas, C. A., Clements, C. F., Seidel, D. P., & Harris, N. C. (2016). Paradigms for parasite conservation. Conservation Biology : The Journal of the Society for Conservation Biology, 30(4), 724–733. https://doi.org/10.1111/cobi.12634
2. Kuris, A. M., Hechinger, R. F., Shaw, J. C., Whitney, K. L., Aguirre-Macedo, L., Boch, C. A., Dobson, A. P., Dunham, E. J., Fredensborg, B. L., Huspeni, T. C., Lorda, J., Mababa, L., Mancini, F. T., Mora, A. B., Pickering, M., Talhouk, N. L., Torchin, M. E., & Lafferty, K. D. (2008). Ecosystem energetic implications of parasite and free-living biomass in three estuaries. Nature, 454(7203), 515–518. https://doi.org/10.1038/nature06970
3. Lefèvre, T., Chiang, A., Kelavkar, M., Li, H., Li, J., de Castillejo, C. L. F., Oliver, L., Potini, Y., Hunter, M. D., & de Roode, J. C. (2012). Behavioural resistance against a protozoan parasite in the monarch butterfly. Journal of Animal Ecology, 81(1), 70–79. https://doi.org/10.1111/j.1365-2656.2011.01901.x
4. Li, Z. P., Geisen, S., Shangguan, H. Y., Tiunov, A. V., Scheu, S., Zhu, Y. G., & Sun, X. (2023). Land use decouples parasite–metazoan host biodiversity associations in soils across subtropical and temperate zones in China. Global Ecology and Biogeography, February, 1–13. https://doi.org/10.1111/geb.13758
5. Sato, T., Watanabe, K., Kanaiwa, M., Niizuma, Y., Harada, Y., & Lafferty, K. D. (2011). Nematomorph parasites drive energy flow through a riparian ecosystem. Ecology, 92(1), 201–207. https://doi.org/10.1890/09-1565.1
6. Windsor, D. A. (1998). Most of the species on Earth are parasites. International Journal for Parasitology,28(12), 1939–1941. https://doi.org/10.1016/S0020-7519(98)00153-2
作者:李志鹏、上官华媛、孙新

