来源:未来智库
获取报告请登录未来智库www.vzkoo.com。
一、EGFR-TKI 概述
(一)蛋白酪氨酸激酶是一种磷酸转移酶,可分为受体型与非受体型
激酶是催化高能供体分子(如ATP)将磷酸基团转移到特定底物的酶。激酶 大致可分为四大类:蛋白激酶、脂肪激酶、果糖激酶和突变型激酶,包含CK1、AGC、 CAMK、CMGC、GYC、TK、TKL、STE、Atypical等。蛋白激酶是关键的酶家族, 能够催化蛋白质的磷酸化过程,该过程是神经信息在细胞内传递的最后环节,可导 致离子通道蛋白及通道门的状态变化。激酶介导的信息传递途径的异常调节可导致 癌症、心血管疾病、神经退行性疾病、代谢紊乱等多种重要疾病。
蛋白酪氨酸激酶(Tyrosine Kinase, TK)可分为受体型(receptor tyrosine kinases,RTKs)与非受体型(non-receptor tyrosine kinases),两种类型都能 够催化ATP上γ-磷酸基团转移至蛋白酪氨酸(Tyr)残基上并使其磷酸化。这一过程 在细胞信号传导通路中占据十分重要的地位,在细胞的生长、分化、代谢、死亡等 过程中起着关键性的作用。人类基因组中,共有58种受体型和32种非受体型。受体 蛋白酪氨酸激酶常见的包括EGFR、PDGFR、FGFR、VEGFR、NGFR等,非受体 酪氨酸激酶包括JAK等。
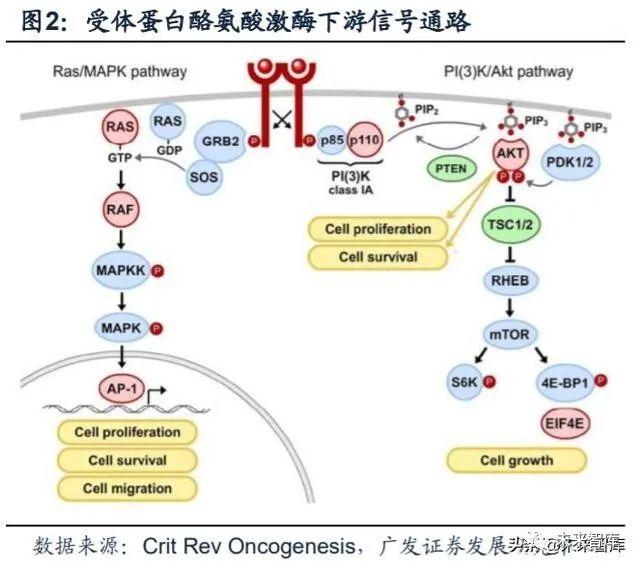
所有的受体蛋白酪氨酸激酶都由三部分组成:跨膜疏水区域,N端胞外生长因 子结合区域和C端胞内激酶催化区域。RTK通过与胞外配体结合诱导自身发生二聚化, 从而激活胞内RTK激酶区域自磷酸化和构象改变,激活一系列下游通路蛋白。激活 的RTK信号通路将胞外生长信号传递到胞质和细胞核中,调控信号转导以及基因的 转录和翻译。因此,RTK是重要的细胞生长信号调控受体。肿瘤是一种生长失控的 疾病,RTK在调控肿瘤细胞的生长、存活和转移发挥重要的作用。酪氨酸激酶靶向 药物可作为ATP与RTK结合的竞争性抑制剂,也可作为RTK的类似物阻断其活性, 进而抑制癌细胞增殖。
(二)EGFR 突变与肺癌的发生高度相关
EGFR(epidermal growth factor receptor)中文名称为表皮生长因子受体, 是一种跨膜酪氨酸激酶受体蛋白,是ErbBs家族中的重要成员之一。ErbBs受体酪氨 酸激酶家族成员包括ErbB1、ErbB2、ErbB3以及ErbB4。EGFR又被称为ErbB-1或 HER1,是原癌基因c-ErbB1的表达产物。它是一个由1186个氨基酸残基组成的跨膜 糖蛋白,分子量为170kDa。像所有RTKs一样,从N末端到C末端主要是由三个部分 结构组成:胞外区(EC)、跨膜区(TM)、胞内区(KD)。EGFR的胞外区可以 进一步分为四个子域分别为I,II,III,和IV区。EGFR的胞外区和配体的复合物晶体 结构研究表明I,II和III区形成一个口袋,配体可以结合到这个口袋中。
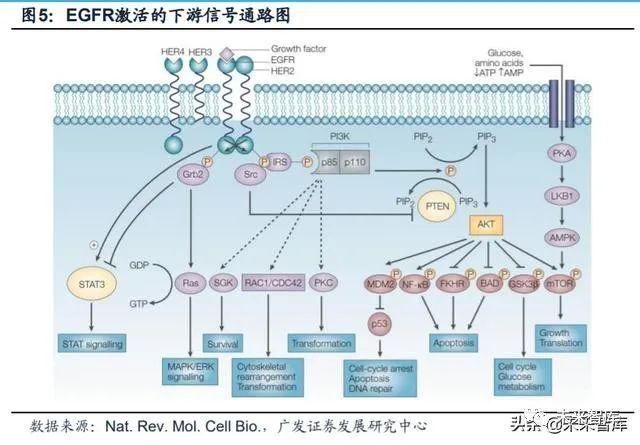
配体能够诱导EGFR二聚化,进而激活其下游通路。主要步骤为:(1)胞外 区与配体的结合。EGFR能够与许多配体结合,包括表皮生长因子(EGF)、转化 生长因子细胞素-α、β-细胞素(BTC)、表皮调节素(EPR)、肝素结合的表皮生 长因子样生长因子(HB-EGF)和双调蛋白(AR)。(2)受体二聚化。在没有配体 结合的情况下,EGFR以单体的形式在细胞表面游离。与配体结合后导致了EGFR的 同源或异源二聚化——取决于其是否与EGFR或其它的ErbB家族成员形成二聚化。(3)激酶区酪氨酸残基磷酸化。配体诱导的二聚化导致胞内区每个受体单体中一些 关键的酪氨酸残基自磷酸化。(4)与下游信号分子通信和下游信号分子的传导。磷 酸化的酪氨酸残基可以作为一系列“接头”和信号分子的结合位点,从而激活细胞 内的下游信号通路,这些通路的激活使得细胞得以增殖,转移和生存。
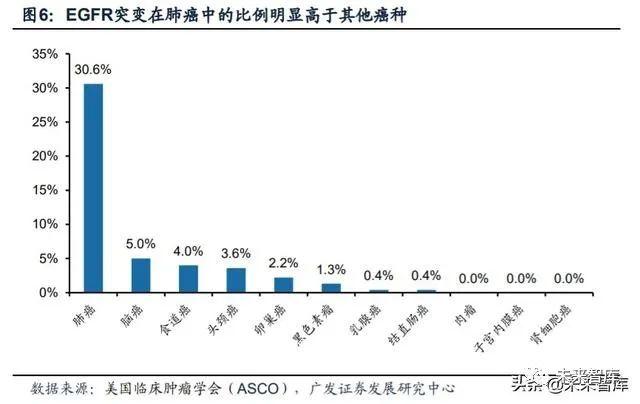
30%的肺癌患者存在EGFR突变。肿瘤的发生、发展、转移是一个十分复杂的 过程,医学界对癌症的共识是:基因变异与恶性肿瘤的发生、发展密切相关,原癌 基因的激活即基因变异是导致肿瘤发生的原因之一。EGFR在细胞周期中起重要作 用,与细胞生长、增殖、迁移有关。其编码基因是一个原癌基因,在生理状态下不 表达或只是有限的表达,处于非激活状态,不具有致癌性。如果编码该受体的基因 发生突变,将会导致多余的EGFR产生,增强了细胞信号的传导,便容易诱发肿瘤。EGFR的过度活化与肿瘤生长和分级(包括增殖、血管发生、浸润和转移)的关键 过程有关。相比于其他癌症,EGFR的突变与肺癌的发展相关性更高,根据美国临 床肿瘤学会(ASCO)的统计, EGFR突变在总肺癌人群中占比高达30.6%,远超 其他癌症。
(三)EGFR:成熟的抗肿瘤靶点
EGFR诱导癌症发生的主要机制可能为:(1)EGFR发生突变引起的结构活 性突变:一般发生在胞外区,极少发生在跨膜区和酪氨酸激酶区;(2)配体产物的 激增:多种肿瘤通过自分泌和旁分泌的方式产生过度的EGF和(或)TGF-α表达, 从而使EGFR信号传导通路过度活化;(3)EGFR自身出现过度表达:原因可能包 括EGFR基因的扩增、EGFR启动子活性的激增、翻译和翻译后修饰的失控等;(4) EGFR的交叉偶联:EGFR与ErbB家族的其他成员相互作用,进而诱导EGFR的酪氨 酸磷酸化而不依赖于配体。
基于其诱导癌症发生的机制,可以通过对EGFR信号的调节来控制肿瘤的恶变 及不良预后,主要有以下几个策略:(1)针对EGFR配体的单克隆抗体药物;(2) 针对EGFR酪氨酸激酶结合区的抑制剂;(3)抑制EGFR返回细胞膜;(4)通过反 义寡聚核苷酸抑制EGFR的合成。
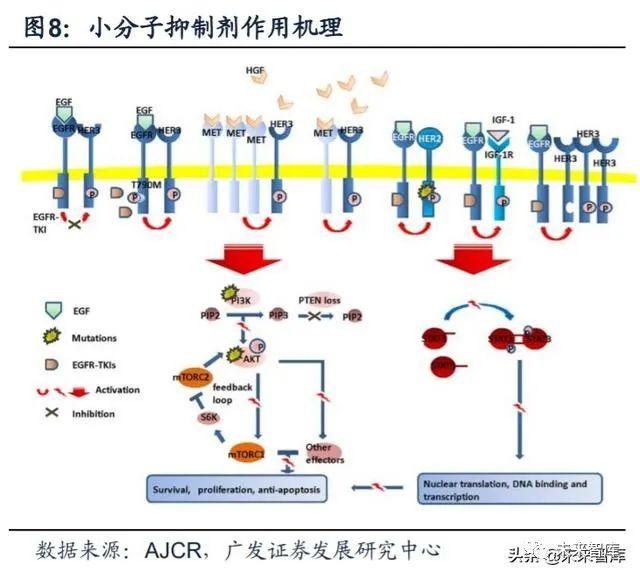
目前的研究主要集中在单抗药物及小分子抑制剂。单克隆抗体主要是靶向 EGFR的胞外区,与 EGFR的内源性配体竞争性地结合胞外区,抑制由配体激活引 起的下游信号通路转导。小分子 EGFR-TKIs 选择性地靶向胞内酪氨酸激酶催化区, 与ATP竞争性地结合激酶的口袋,从而抑制酪氨酸的磷酸化,中断激酶催化引起的 下游信号转导。
二、EGFR-TKI 药物:针对突变,不断发展
(一)EGFR-TKI 针对 EGFR 突变阳性非小细胞肺癌患者
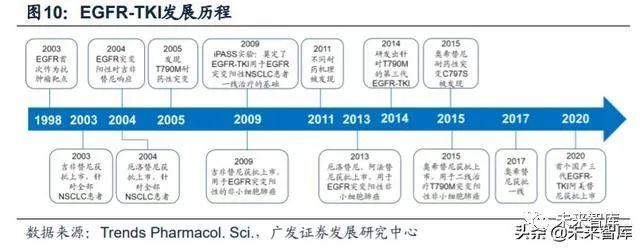
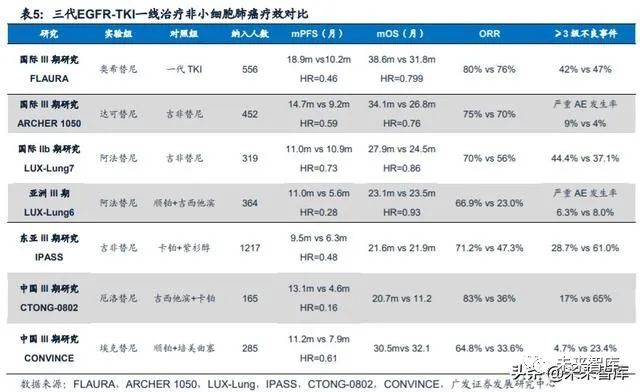
2003年,第一代小分子EGFR激酶抑制剂吉非替尼,因其在142位对紫杉醇以 及顺铂都失效的非小细胞肺癌患者身上取得良好反应效果,而获得了美国FDA加速 上市通道。但随后的一系列III期临床试验显示虽然吉非替尼可以显著提升ORR,但并不能延长患者的中位总生存期,FDA于2005年撤回批准。不过吉非替尼对10%左 右的病人有着较好的疗效,这些患者的共同特点是其体内均存在EGFR的突变情况。2009年,IPASS以EGFR激酶抑制剂作为一线用药对EGFR突变病人进行随机临床III 期实验中,证明了激酶抑制剂相比其他一线化疗药对晚期EGFR突变的非小细胞肺 癌患者有更好的效果。这一实验结果奠定了EGFR-TKI用于EGFR突变阳性的非小细 胞肺癌患者一线治疗的基础。
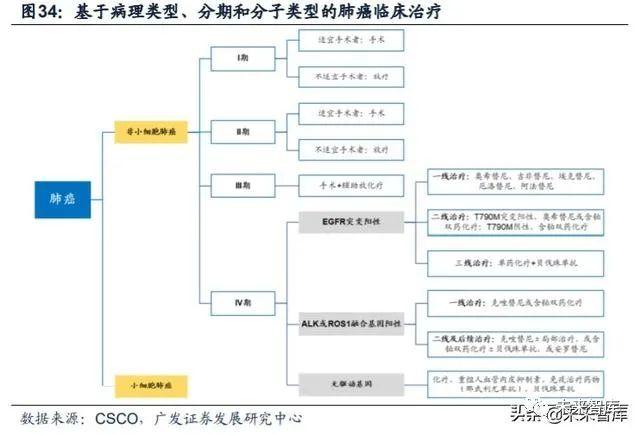
19号外显子的缺失Del19及21号外显子的L858R突变是EGFR主要突变形式, 占全部突变的84.6%,大部EGFR-TKI的研究都是针对这两种经典突变。EGFR的基 因组包含28个外显子,其中具有编码酪氨酸激酶功能的外显子位于18到24号,超过 90%的与肺癌相关的EGFR突变发生在外显子19到21号上。外显子19是与肺癌相关 的突变频率最高的,可占总突变的45%。
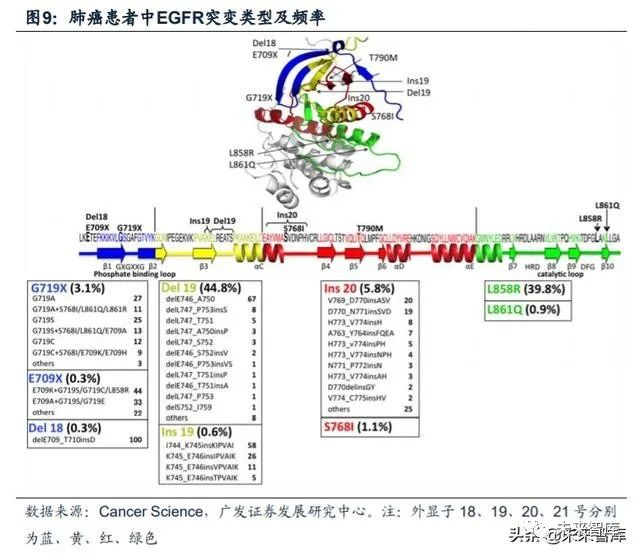
目前全球已经上市三代靶向EGFR突变的小分子TKI药物。三代小分子抑制剂 的工作原理均为与ATP分子竞争蛋白激酶上的结合位点结合,以达到抑制剂酶活性 的效果。不同代别药物之间的差异在于其针对的EGFR突变类型以及结合方式的不 同。(1)一代EGFR-TKI 药物:与 EGFR可逆性结合,主要包括吉非替尼、厄洛 替尼和埃克替尼;(2)二代EGFR-TKI药物:多为多靶点小分子药物,能与EGFR 酪氨酸形成共价键,形成不可逆性结合,同时对ErbB家族其他成员(如ErbB-2 、 ErbB-4)产生抑制活性。主要包括阿法替尼和达可替尼;(3)三代EGFR-TKI药物:高度选择性T790M突变小分子抑制剂,主要包括奥希替尼和阿美替尼。
(二)一代及二代 EGFR-TKI 简介(略)
(三)第三代 EGFR-TKI:针对 T790M 耐药突变
为解决第一代TKI药物引发的T790M耐药性突变,以及二代TKIs对EGFR野生 型的抑制带来的严重副作用,不可逆共价结合型的第三代EGFR-TKI应运而生。第三 代EGFR-TKI既要抑制 EGFR原发性突变(Del19/L858R),又要抑制获得性突变 (T790M),同时还需要对EGFR野生型的抑制作用相对较弱。
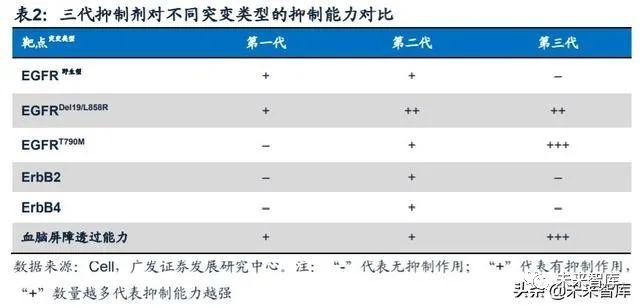
WZ4002是第一个三代EGFR激酶抑制剂,虽未上市,但开创了基于嘧啶结构 的设计思路。体外实验结果显示,相比于基于喹唑啉结构的二代TKIs,WZ4002对 T790M突变的IC50数值小30-100倍,对EGFR野生型的IC50数值大100倍左右,说明 该药对EGFR的各类突变有较好的选择性,同时该药与激酶蛋白的共结晶试验结果 也为这一选择性提供了理论支持。目前在国内上市的两款第三代EGFR-TKI药物,阿 斯利康的奥希替尼及豪森的阿美替尼,母核均是嘧啶结构。
三、第三代 EGFR-TKI:目前效果最好的 EGFR 突变 阳性晚期 NSCLC 一线用药
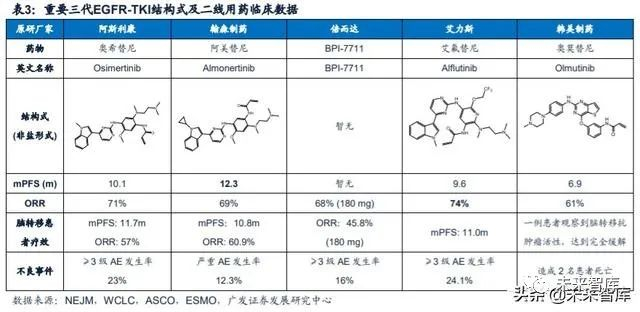
目前,国内已有两款第三代EGFR-TKI药物获批上市,分别是阿斯利康的奥西 替尼(一线、二线)和翰森制药的阿美替尼(二线);艾力斯的艾氟替尼已经提交 二线治疗的新药申请;韩美制药的Olmutinib早在2016年5月便在韩国获批上市,但 因副作用严重预计不会进入中国市场;另外我国还有12款药物处于临床阶段。随着 三代EGFR-TKI药物进入医保并获批一线,将逐步完成对一代药物的替代,进入快速 放量阶段。
(一)奥希替尼:一线之争,大局已定
阿斯利康的奥希替尼(商品名:泰瑞沙)是第一个获批上市的第三代EGFR-TKI, 可选择性地抑制敏感EGFR突变(Del19/L858R)和EGFR T790M耐药突变,并对 中枢神经系统(CNS)转移NSCLC患者有疗效。于2015年获得美国FDA批准,2017 年进入中国。截至2019年底,奥希替尼已登陆美国、欧洲、日本、中国、加拿大等 87个国家及地区,其中80个国家及地区作为一线用药。
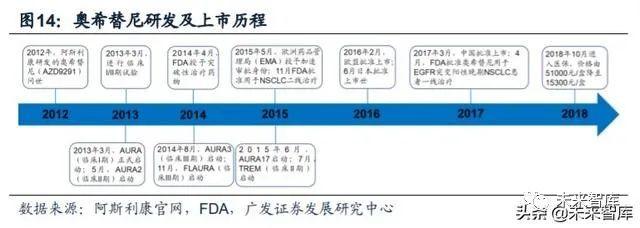
奥希替尼为不可逆共价结合型药物,可选择性抑制获得性T790M耐药突变。奥希替尼结构中含有丙烯酰胺基,能够与EGFR基因催化域的ATP结合位点边缘 C797结合,形成不可逆的共价键,从而抑制癌细胞的增殖。奥希替尼与EGFR相关 基因结合后,可能与通过阻断突变EGFR同源二聚化或诱导EGFR突变细胞降解等途 径,从而阻断EGFR下游信号传递有关,口服奥希替尼治疗后的病人,其肺部组织 活检发现大部分治疗后的肿瘤EGFR通路的蛋白受到抑制。奥希替尼对EGFR基因抑 制能力大小为T790M>Del19/L858R>EGFR野生型,体外试验中,对T790M的亲 和力是野生型的200倍。相较于第一代TKI,奥希替尼能更有效地抑制T790M突变细 胞 系 中 的 磷 酸 化 ( H1975 (L858R/T790M), PC-9VanR (exDel19/T790M), IC50<15nmol/L),也能更有效地抑制下游信号转导底物(pAKT、pERK)。
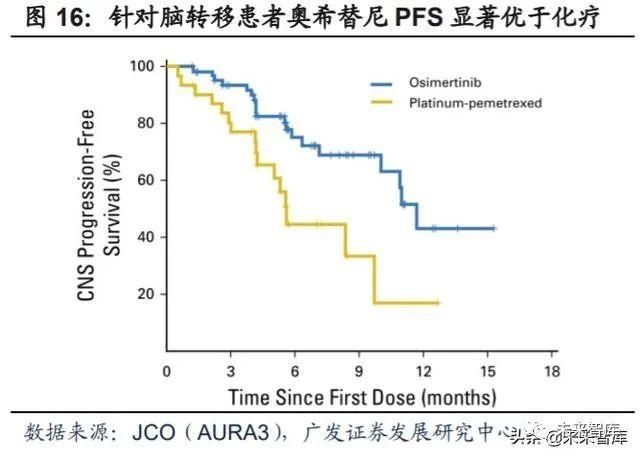
奥希替尼2015年获批用于T790M耐药性突变NSCLC患者的二线治疗,临床疗 效显著优于化疗。针对经过一线EGFR-TKI治疗后T790M阳性的NSCLC患者, AURA3(III期临床试验)对比了奥希替尼(实验组,n=279)和常规铂类+培美曲塞 (对照组,n=140)的临床效果。相比于标准化疗,奥希替尼组的疗效有了显著提升, ORR明显提高(71% vs 31%),显著延长患者mPFS(10.1m vs 4.4m; HR=0.30, 95%CI: 0.23-0.41)。安全性方面,发生≥3级治疗相关不良事件(AE)的比例分别 为23%和47%。
针对发生脑转移患者,奥希替尼治疗效果优于标准化疗。约有40%EGFR突变 的非小细胞肺癌患者会发生中枢神经系统(CNS)转移,AURA3脑转移亚组分析显 示,相比于铂类+培美曲塞(对照组,n=41),奥希替尼(实验组,n=75)能够显 著延长患者mPFS(11.7m vs 5.6m; HR=0.32, 95%CI: 0.15-0.69),ORR更高(40% vs 31%)。以上临床结果使得奥希替尼迅速获批二线。
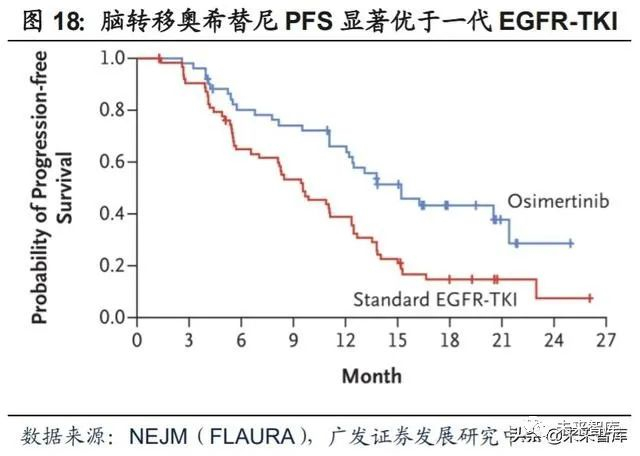
2017年获批一线,完成对一代EGFR-TKI药物的取代指日可待。获批二线上 市后,阿斯利康又设计了FLAURA临床试验向一线拓展。FLAURA研究是一项随机、 双盲、国际多中心的III期临床研究,纳入既往未接受任何治疗的局部晚期或转移性 EGFR突变阳性的NSCLC患者共556例,旨在评价比较奥希替尼与第一代EGFR-TKI 药物(吉非替尼或厄洛替尼)的有效性与安全性。结果显示,奥希替尼的临床疗效 全面优于一代EGFR-TKI药物。针对脑转移患者,相比一代EGFR-TKI药物(对照组, n=63),奥希替尼(实验组,n=53)也能够显著延长患者mPFS(15.2m vs 9.6m; HR 0.47, 95%CI 0.30-0.74)。2017年4月,FDA批准奥希替尼用于EGFR突变阳性非小 细胞肺癌患者的一线治疗。
2019年8月,阿斯利康公布了FLAURA研究数据更新,奥希替尼较一代 EGFR-TKI药物能够明显提升患者总生存期,mOS(38.6m vs 31.8m; HR=0.80, 95%CI: 0.64-1.00),三年生存率(54% vs 44%)。
针对未经放疗治疗的脑转移患者,奥希替尼相比放疗是更优选择。为了评估 奥希替尼治疗未经放疗治疗的EGFR突变阳性晚期NSCLC脑转移患者的疗效,阿斯 利康进行了II期临床试验OCEAN研究。该研究纳入了65名患者并分为两个队列, T790M队列包含40名经过EGFR-TKI治疗并且T790M突变阳性的患者,一线队列包 含25名未经任何EGFR-TKI治疗的患者,2020年的ASCO年会公布了T790M队列的 结果。根据PAREXEL评估标准(为评估脑转移疗效的标准)及RECIST标准的脑转 移响应率(BMRR)分别为66.7%(95% CI, 54.3-97.1)及70.0%(95% CI, 49.9-90.1), mPFS为7.1个月(95% CI, 3.4-13.6),RECIST评估的ORR为40.5%(95% CI, 24.7-57.9)。对于脑转移患者,奥希替尼取得了惊艳的疗效,患者应该先于放疗接 受奥希替尼的治疗。
奥希替尼获各大指南一线治疗首选推荐。基于其相对前两代TKI药物的绝对疗 效优势,多国指南,包括2019年美国国立综合癌症网络(NCCN)指南、2018年欧 洲临床肿瘤学会(ESMO)指南、日本肺癌诊疗指南,均将奥希替尼作为EGFR阳性 晚期NSCLC患者一线用药的首选推荐。
奥希替尼全球销售迅速放量。截至2019年底,奥希替尼已在全球80个国家及 地区获批,用于EGFR突变的晚期非小细胞肺癌的一线治疗。2019年,奥希替尼全 球销售额达到31.9亿美元,较上年同比增长71.5%,是阿斯利康最为畅销的抗肿瘤 产品,目前处于快速放量阶段。同时,中国及日本的市场份额占比也在不断地提升, 2019年中国及日本合计销售额为11.1亿美元,占总量的34.9%。
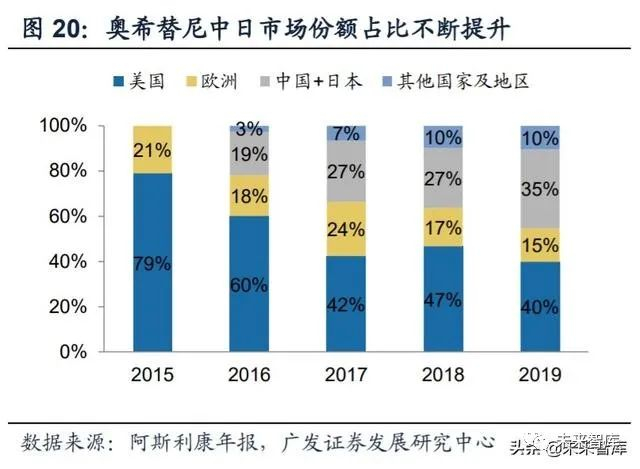
对于中国市场,奥希替尼于2017年3月获批二线,2018年10月进入医保,2019 年9月获批一线,在中国的销售额高速增长。从2016年9月受理,到2017年3月获批 上市,奥希替尼仅7个月的上市时间创造了进口药在国内的最快获批上市速度。2018 年10月,奥希替尼通过医保谈判进入国家目录,价格从1700元/80mg降至510元 /80mg,降幅达70%,目前月用药费用为15300元/月。根据米内样本医院数据,奥 希替尼在中国的销售额逐季升高,2019年样本医院销售额为9.48亿元。
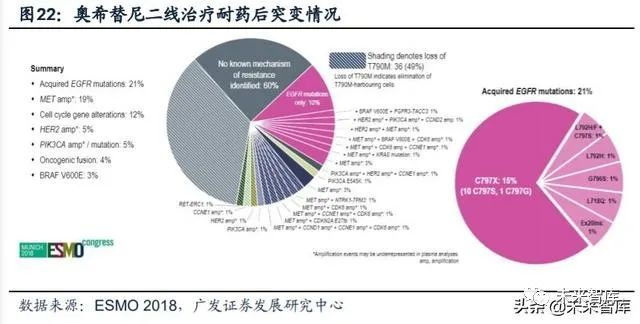
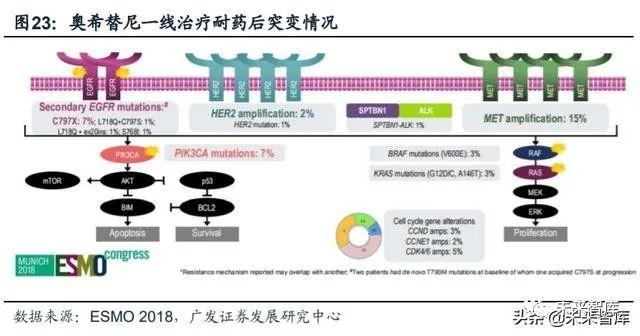
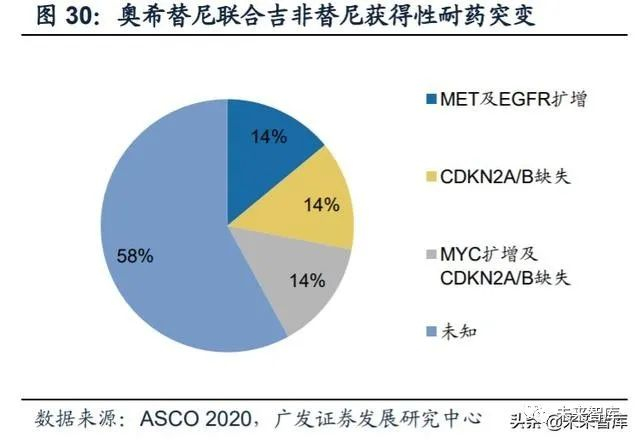
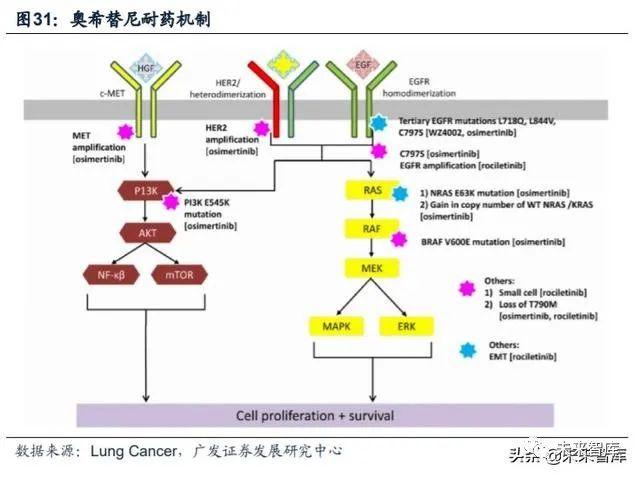
奥希替尼耐药机制:突变类型相对分散,EGFR获得性突变以C797S为代表。2018年ESMO大会上,阿斯利康公布了奥希替尼耐药后的基因突变情况。(1)二线 使用奥希替尼耐药后的突变情况(AURA3研究):73例患者中,EGFR获得性突变占21%,并且以C797X为主(15%;C797S 14%、C797G 1%);非EGFR突变主 要包括MET扩增(19%)、HER2扩增(5%)等;另外,49%患者出现T790M缺失。(2)一线使用奥希替尼耐药后的突变情况(FLAURA研究):91例患者中,最常见 的耐药机制包括MET扩增(15%)及EGFR-C797X突变(7%);其他耐药性突变还 包括PIK3CA(7%)、HER2扩增/突变(3%)等;未发现T790M突变。
目前阿斯利康对于奥希替尼的后续开发主要还有用于辅助治疗(ADAURA)、 作为维持疗法针对局部晚期不可切除的病灶(LAURA)、与化疗联用(FLAURA2)、 与潜在新药联用解决EGFR-TKI耐药性突变(SAVANNAH、ORCHARD)。具体情 况将在本报告第四部分中讨论。
(二)阿美替尼:首个国产第三代 EGFR-TKI
获批二线,翰森制药阿美替尼成为首个国产第三代EGFR-TKI药物。2020年3 月18日,NMPA批准翰森制药自主研发1.1类创新药阿美乐®(甲磺酸阿美替尼片) 上市,用于“既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗进展, 且T790M突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者”的治疗, 成为首个获批上市的国产第三代EGFR-TKI药物,其化合物专利于2035年到期。阿 美替尼于2020年4月开始在药店正式售卖,价格为19800元/盒,十天一盒。目前的 赠药政策为前三个月买一送二,三个月后进入观察期,若无进展全赠药至第12个月 (如果疾病出现进展,可赠送培美曲塞化疗方案至第12个月),12个月后无进展的 第二年买一盒赠至疾病发生进展或第24个月。
体外药效学研究显示,阿美替尼片对EGFR T790M耐药突变的酶活性具有强 效的抑制作用。药代动力学研究显示,阿美替尼片并无脱甲基的代谢路径,从而避 免了因野生型EGFR抑制可能引起的皮肤和胃肠道损伤。
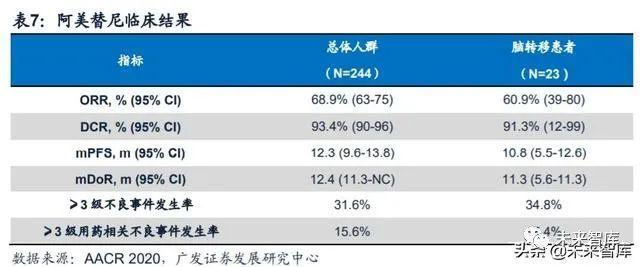
阿美替尼是全球首个二线用药mPFS超过1年的三代EGFR-TKI,安全性或优 于奥希替尼。阿美替尼的获批基于APOLLO研究的临床结果,该研究是一项多中心、 开放式、单臂、II期临床研究,共入组244例既往接受过一代EGFR-TKI药物EGFR T790M突变阳性的非小细胞肺癌患者。2020年美国癌症研究协会(AACR)年会上, 翰森制药公布了APOLLO随访11.8个月的最新临床结果,总体人群ORR为68.9%, DCR为93.4% ,mDoR为12.4个月,mPFS为12.3个月,是全球首个二线用药mPFS 超过1年的三代EGFR-TKI。阿美替尼还能够有效控制脑补病灶,23例脑转移患者的 ORR为61.5%,mPFS长达10.8个月。另外,阿美替尼不仅疗效佳且安全性好,大 部分不良事件均为可控的1级及2级水平,严重不良事件发生率为12.3%,仅少于3% 的患者因用药导致的不良事件而停药。没有患者出现间质性肺炎、三级皮疹、QT间 期延长的不良事件,相对比,奥希替尼作为二线用药的AURA3研究中,这三种不良 事件的发生率分别为:3.9%、0.7%、3.6%。
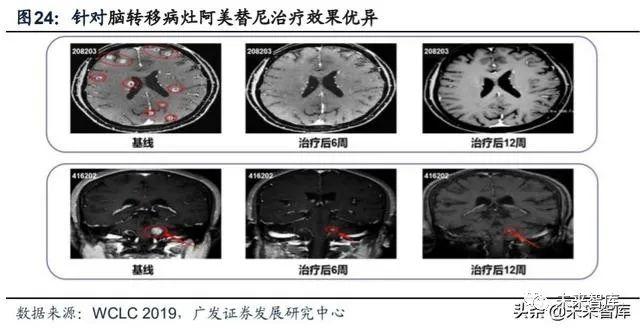
二线进入医保及一线获批上市均有望于2021年达成,将帮助阿美替尼迅速放 量。我们预计在2021年进行的医保谈判会将阿美替尼纳入到国家目录。另外,评价 阿美替尼一线疗效的临床试验已于2019年完成全部患者的入组,该研究是一项随机、 双盲、III期临床试验(登记号:CTR20181951),拟招募350名患者,旨在比较阿 美替尼与吉非替尼一线治疗EGFR突变晚期NSCLC的效果。预计翰森制药将在今年 完成该试验并提交上市申请,若进展顺利,将在明年获批一线上市。
(三)艾氟替尼:早期临床结果优异,预计是第二个获批的国产第三代 EGFR-TKI
甲磺酸艾氟替尼是上海艾力斯医药科技有限公司自主研发的1.1类新药,二线用 药上市申请于2019年12月获药审中心承办,预计2020年下半年获得上市批准。
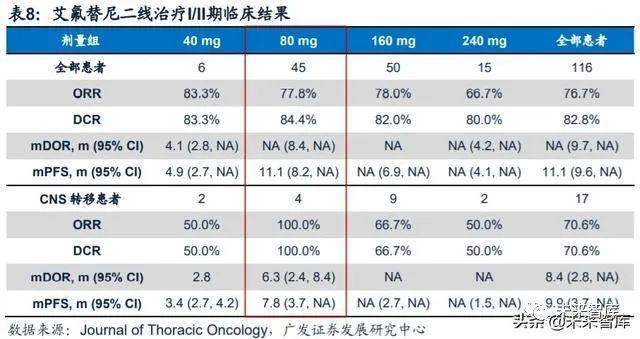
艾力斯在2019 ESMO年会上公布了艾氟替尼治疗EGFR-TKI耐药后T790M突变阳性NSCLC患者的剂量递增和剂量扩展I/II期临床结果,该研究共纳入130名患者, 对于116例疗效可评估受试者的ORR为76.7%(95% CI:68.0-84.1),DCR为82.8%。其中80mg组ORR为77.8%,DCR为84.4%。I/II期临床结果表明,艾氟替尼40-240mg/ 日能够被受试者良好耐受,80mg/日剂量的安全性优于高剂量。
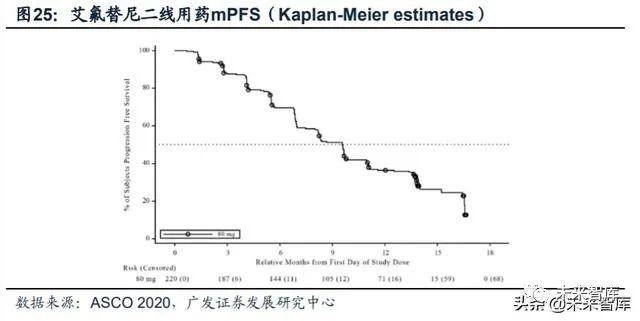
艾力斯2020年ASCO年会上公布了截至2020年1月29日(中位随访时间9.6个 月)的IIb期临床试验结果,220例可评估受试者的ORR为74.1%,DCR为93.6%。mPFS为9.6个月,mOS未达到。针对89例脑转移患者疗效优异,mPFS为11.0个月。对于29例具有至少1个可测量CNS转移灶患者的ORR为65.5%,DCR为100%。
安全性良好,结构创新或提高药物安全性。艾氟替尼代谢途径更加优化,无 低选择性活性代谢产物,在临床给药20-240mg/日剂量范围内具有良好的耐受性, 不良反应发生率低,安全性良好。根据I期、I/II期、IIb期临床试验中80mg/日及以上 的339名患者的临床数据,艾氟替尼在胃肠道及皮肤不良反应方面的发生率整体较低, 其中腹泻、皮疹、皮肤干燥、瘙痒症等不良反应发生率分别为8.3%、8.8%、0.6% 及5.6%,均低于奥希替尼。同时没有患者发生QTc间期大于500毫秒事件及间质性 肺炎。IIb期临床试验中,三级及以上不良事件发生率为24.1%,治疗相关三级及以 上不良事件发生率为10.0%。目前的临床结果表明艾氟替尼的耐受性可能优于奥希 替尼,不过具体结论仍需更多的临床数据支撑。结构上艾氟替尼包含三氟乙氧基吡 啶结构,与奥希替尼的嘧啶母核不同,可能使其对野生型EGFR的抑制能力更低, 从而提高药物耐受性。
一线治疗预计2022年提交NDA。艾氟替尼针对晚期NSCLC的确证性临床试验 正在进行中,该试验为艾氟替尼单药一线治疗伴有EGFR敏感突变的局部晚期或转 移性非小细胞肺癌患者的随机、双盲、平行、吉非替尼对照的多中心III期临床研究 (登记号:CTR20182519),主要临床终点为患者PFS。该研究已于2019年6月正 式启动,计划招募358名患者,目前已完成招募,预计将于2022年提交NDA。
拓展海外市场,预计2020年三季度获得FDA临床试验许可。公司目前已向FDA 提交二线适应症的药代动力学桥接试验申请,预计将于2020年三季度取得FDA临床 试验许可。
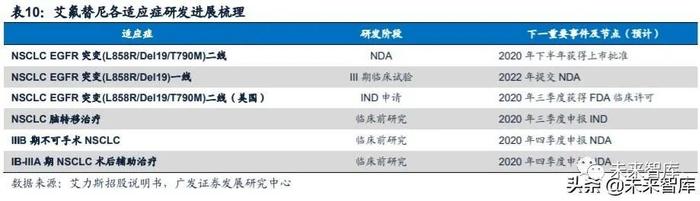
为提高艾氟替尼的综合竞争力,艾力斯还设计了一系列的后续的临床研究计 划,主要包括针对脑转移患者的治疗、联合治疗、辅助治疗等。
(四)国内在研三代 EGFR-TKI 药物:机遇与挑战并存
除上述已上市/已申报NDA的药物外,目前还有12款国产三代EGFR-TKI药物 处于临床阶段,分别针对非小细胞肺癌的一线、二线治疗,包括倍而达的BPI-7711 (已公布I期临床数据)、贝达药业的D-0316、奥赛康的ASK120067等。若能成功 上市,将进一步改变我国的三代EGFR-TKI药物市场格局,扩大行业的市场规模。
BPI-7711:I期临床数据展现出巨大潜力,有望成为第四个申请NDA的国产三 代药物。BPI-7711是上海倍而达药业自主研发的三代EGFR-TKI药物,拥有全球化 合物专利。体外细胞实验中表现出对EGFR(T790M、L858R、Del19)基因突变的非 小细胞肺癌明显的抗肿瘤活性,且IC50比EGFR基因野生型的抑制浓度低35倍以上, 体现了较好的安全性。
2019年NACLC年会上,倍而达公布了BPI-7711治疗EGFR/T790M突变阳性晚 期或复发NSCLC的I期临床数据,该研究纳入162例受试者,128例疗效可评估受试 者的总ORR为63.3%,DCR为93.8%;其中180 mg组ORR为73.1%,DCR为96.2%。在51例脑转移疗效可评估受试者中,总ORR为35.3%,DCR为96.1%;其中180 mg 组ORR为44.0%,DCR为100%。安全性良好,对于全部患者三级及以上不良事件 发生率为17.3%,与用药相关的发生率为8.0%。三级以上皮疹发生率为1.9%,QT 间期延长发生率为1.9%,没有患者出现间质性肺炎。基于其I期临床研究表现出的优 异疗效及安全性,BPI-7711有望成为第四个申请上市的国产三代TKI。
(五)国际第三代 EGFR-TKI 药物研发进展:目前两款药物在研
自从2012年第三代EGFR-TKI药物启动临床研究以来,除奥希替尼及仅韩国上 市的Olmtinib外,大部分药物均因各种原因逐渐停止了研发,目前仅Yuhan与杨森合 作研发的拉泽替尼(Lazertinib)及诺华的纳扎替尼(Nazartinib)处于临床II期阶段。
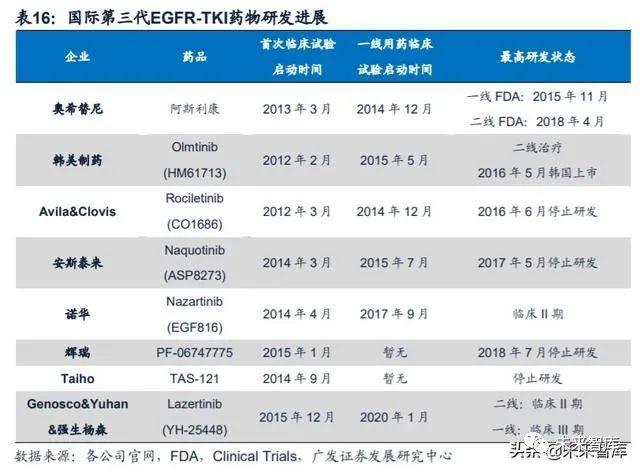
拉泽替尼:二线治疗脑转移效果优异,一线临床正在进行。2020年ASCO年 会上公布了拉泽替尼作为二线用药I/II期最新临床研究结果(NCT03046992),截至 2019年9月30,共有181名患者在7个剂量水平上接受了至少一剂20-320mg拉泽替尼 的治疗。其中脑转移完全分析包含64名患者(T790突变率86%),颅内疾病控制力 (IDCR)为90.6%(95% CI: 83.5-97.8),颅内无进展生存期未达到(95%CI: 14.0-NR)。共22例患者可评估反应,颅内客观缓解率(OIRR)及颅内疾病控制率 (IDCR)分别为54.5%(95% CI: 33.7-75.4)和90.9%(95% CI: 78.9-100)。对 于76名接受240mg拉泽替尼治疗且T790M突变阳性的患者,ORR为57.9%(95% CI: 46.8-69.0),DCR为89.5%(95% CI: 82.6-96.4),mPFS为11个月(95% CI: 5.6-16.4), mDoR为13.8个月(95% CI: 9.6-NR)。
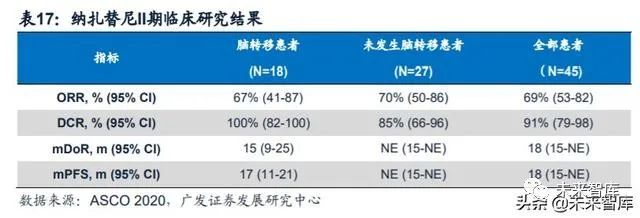
耐受性良好,三级以上治疗相关不良事件 发生率为6%。拉泽替尼用于一线治疗的临床研究(登记号:NCT04248829)目前 正在招募中。纳扎替尼:一线用药初步疗效令人满意。诺华在2020年ASCO年会上更新了 纳扎替尼用于治疗EGFR突变阳性晚期NSCLC患者的II期临床研究结果。该研究共纳 入45例患者,ORR为69%,DCR为91%,mPFS达到18个月。mOS未达到,已经超 过33个月。1年总生存率为90%,2年总生存率为65%,3年总生存率为56%。常见 (发生率≥10%)的3/4级不良事件包括:斑丘疹(11%)及脂肪酶升高(11%)。
四、辅助治疗、联合治疗等应用有望进一步拓展三代 TKI 市场空间
(一)联合治疗:预计将显著提升三代 TKI 药物疗效
一代EGFR-TKI药物联合治疗效果良好,三代TKI联合疗效值得期待。目前, 一代EGFR-TKI药物的联合治疗思路主要是:(1)联合放/化疗;(2)联合抗血管 生成药物,如雷莫芦单抗、贝伐珠单抗等单抗或小分子靶向药物安罗替尼。多项临 床研究表明,相比一代TKI单药或化疗,两种联合治疗思路都能够显著提升治疗效果。2019年CSCO肺癌指南将吉非替尼或厄洛替尼+化疗、厄洛替尼+贝伐珠单抗作为IV 期EGFR突变阳性NSCLC的一线治疗II级推荐,2020版NCCN指南将厄洛替尼+雷莫芦单抗、厄洛替尼+贝伐珠单抗作为一线治疗的推荐。2020年6月1日,礼来宣布FDA 批准厄洛替尼联合雷莫芦单抗用于EGFR突变阳性晚期/转移性非小细胞肺癌的一线 治疗。由于三代EGFR-TKI药物单药的疗效相比一代TKI有了显著的提升,因此三代 TKI药物联合化疗/抗血管生成药物的疗法十分值得期待。
奥希替尼联合贝伐珠单抗一线治疗EGFR突变阳性非小细胞肺癌的II期临床研 究结果(NCT02803203)。该研究入组的49例患者均可进行疗效评估,ORR为80% (95% CI, 67%-91%),mPFS为19个月(95% CI, 15-24),1年无进展生存率为 76%,1年总生存率为91%。耐药机制主要包括:转为小细胞肺癌、EGFR L718Q突变、EGFR C797S突变。目前初步的疗效数据支持进行进一步的临床试验证实奥希 替尼联合贝伐珠单抗的效果。
(二)辅助治疗:针对早期肺癌,将进一步扩大三代 TKI 用药范围
肿瘤辅助治疗是针对手术直接切除肿瘤组织后的治疗,用于消灭体内仍然残 余的癌细胞,可以降低肿瘤复发或向其他部位转移的可能性。对于II、IIIA期NSCLC 患者,以顺铂为基础的辅助化疗是辅助治疗的金标准,但5年绝对获益仅为5.4%。同时辅助化疗血液和非血液毒性大,患者中粒细胞减少、贫血、血小板减少和发热 性中性粒细胞减少明显,降低患者顺应性,影响疗效。另外,目前术后的复发率也 较高,I期及III期NSCLC的5年复发率分别为45%及76%。
针对早期EGFR突变阳性NSCLC患者,奥希替尼辅助治疗效果超预期。虽然 EGFR-TKI药物已在肺癌的治疗中起到了关键性的作用,但目前靶向药物的主战场仍 然聚焦在局部治疗方法无效的晚期肺癌。2020年ASCO大会上,阿斯利康公布了临 床试验ADAURA研究的结果,使得ADAURA成为全球第一个显示EGFR-TKI用于肺 癌辅助治疗具有显著的统计学意义和临床意义的研究。ADAURA是一项III期、双盲、 随机的临床研究,旨在对比奥希替尼与安慰剂对于肿瘤完全切除的、EGFR突变阳 性的IB期、II期及IIIA期非小细胞肺癌患者的疗效。该研究纳入了682名受试者,主要 终点是无病生存期(disease-free survival,DFS),次要终点为总生存期及5年总 体生存率。截至2020年1月17日,对于II-IIIA期患者,相对于安慰剂,服用奥希替尼 治疗的患者DFS有83%的提升(P<0.0001),奥希替尼组及安慰剂组的2年无病生存 率分别为90%及44%。如果考虑更早期患者,对于全部IB-IIIA期患者,相比安慰剂 组,奥希替尼组患者的DFS有79%的提升,奥希替尼组及安慰剂组的2年无病生存率 分别为89%及53%。OS目前尚未成熟(4%成熟),682名受试者中共有29人死亡, 其中奥希替尼组死亡数为9,安慰剂组死亡数为20。奥希替尼的安全性优异,大部分 的不良事件均为轻度的1-2级,3级及以上AE发生率低。
辅助治疗若能成功获批,将进一步扩大第三代TKI药物的用药范围,提升其市 场规模。非小细胞肺癌患者中,I-IIIA期占全部患者的58%,基数远大于IIIB-IV期患 者。目前I期患者的五年总生存率为60%-74%,II期为47%-55%,IIIA期为38%。当 前I-III期非小细胞肺癌的标准辅助治疗方法为化疗,但5年绝对获益仅为5.4%。因此, 若奥希替尼用于辅助治疗能够成功获批,国产三代EGFR-TKI药物也会相应获益,整 体市场规模会随之提升。
(三)联合用药解决三代 TKI 治疗后的耐药问题
奥希替尼联合沃利替尼,针对MET扩增导致的耐药性问题。沃利替尼是和记 黄埔医药与阿斯利康合作研发的MET-TKI,奥希替尼一线用药后,15%的患者耐药 机制为MET扩增。阿斯利康设计了一项开放标签、多中心Ib期临床试验TATTON (NCT02143466)来探究奥希替尼与沃利替尼联用的疗效,研究纳入了年龄≥18岁, 既往治疗进展的MET扩增及EGFR突变阳性局部晚期或转移性非小细胞肺癌患者, 共有4个队列(A:剂量爬坡队列;B:剂量扩增队列;C:日本患者剂量扩增队列;D:沃利替尼300mg队列)。阿斯利康于2020年3月在《柳叶刀肿瘤学》上公布了B 和D队列的最新中期分析结果。
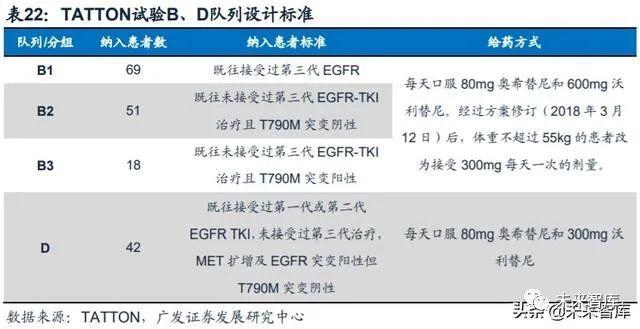
奥希替尼+沃利替尼对于既往接受EGFR-TKI药物治疗后产生耐药性、MET扩 增+EGFR突变阳性的晚期NSCLC患者,展现出了较好的抗肿瘤活性。对于B2、B3、 D中既往未接受过第三代TKI治疗的患者,奥希替尼联合沃利替尼展现出了较好的疗 效ORR分别为65%、67%与64%,而对于B1患者,ORR仅为30%,说明B1组纳入 的患者之前存在着比较严重的过早治疗的问题。安全性方面,B、D队列中≥3级不 良事件发生率分别为57%及38%。对于既往接受EGFR-TKI药物治疗后产生耐药性、 MET扩增+EGFR突变阳性的晚期NSCLC患者,以往除了化疗之外并没有其他的选 择,奥希替尼+沃利替尼为此类病人提供了一个较好的治疗选择。不过由于TATTON 只是一个单臂、I期的试验,且纳入的患者数较少,该方案的可行性还需要进一步的 临床支持(SAVANNAH研究)。
奥希替尼联合吉非替尼:一线治疗可能延缓耐药。由于奥希替尼能够抑制吉 非替尼的获得性耐药突变EGFR T790M,吉非替尼能够抑制奥希替尼的耐药性突变 EGFR C797S。临床前研究显示,奥希替尼与吉非替尼联用可以做到抑制EGFR通 路继发性突变,从而有望延缓获得性耐药突变的发生,延长PFS。阿斯利康设计了 一项I/II期临床研究(NCT03122717),并在2020年ASCO年会上公布了最新的临床 结果。截至2019年7月,该研究已纳入27例未经治疗的EGFR突变阳性晚期NSCLC 患者,ORR为88.9%(95% CI: 71.9%-96.1%),DCR为100%(95% CI: 87.5%-100%)。基于先前的研究,用药后血液中EGFR突变的清除速度预示着治疗效果,在17例可 测量基线血浆EGFR AF(等位基因片段)的患者中,治疗两周后仅12%患者可检出 血液EGFR突变,相比治疗前65%的突变检出率出现了显著的下降。mPFS尚未达到, 中位随访时间为15.3个月时,33%的患者出现了疾病进展,预估的mPFS为22.5个月, 优于奥希替尼单药数据(mPFS=18.9个月)。对7例耐药进展患者进行基因二代测 序,没有出现C797S突变。奥希替尼联用吉非替尼导致超过30%的患者因为药物毒 性停止治疗,其中吉非替尼8例(29.6%),奥希替尼1例(3.7%)。
(四)罕见突变 EGFR ins20:奥希替尼加量治疗展现一定效果
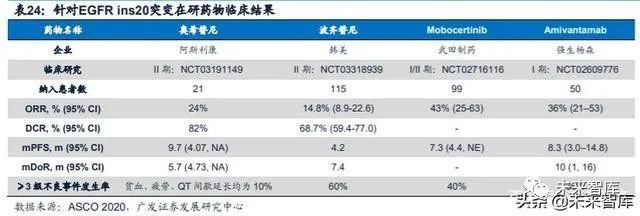
EGFR 20号外显子插入突变(ins20)在EGFR突变非小细胞肺癌患者中的发 生率为4%-10%,目前第一代及第二代EGFR-TKI药物对EGFR 20ins突变患者的疗 效均欠佳。一项II期临床研究(NCT03191149)表明,加量的奥希替尼对EGFR 20ins 突变患者展现出了一定疗效。该研究共纳入21例EGFR ins20突变阳性晚期NSCLC 患者,使用奥希替尼160 mg/天进行加量治疗(正常用量为80 mg/天)。ORR为24%, DCR为82%,mPFS为9.7个月。
(四) “第四代”EGFR-TKI:针对 C797S 顺式突变
针对EGFR C797S顺式突变为下一代EGFR-TKI药物的研发方向。C797S突变 有顺式及反式两种突变,其中反式突变可以采取一代+三代TKI联合用药的方式治疗。顺式突变对目前市场上的所有EGFR-TKI耐药,因此抑制L858R/T790M/C797S及 Del19/T790M/C797S三重突变是下一代TKI药物的研发方向。然而EGFR C797S顺 式突变虽然为三代TKI耐药后的主要EGFR获得性突变,却并不是奥希替尼耐药的主 要原因,因此我们预计,即便未来几年有四代产品较快上市,也不会对三代TKI市场 产生过大的冲击。
强生的在研药物JBJ-04-125-02可对L858R/T790M/C797S三重突变产生抑制 作用,同时与奥希替尼联用还能起到增效的作用,但却对Del19没有明显的活性,该药目前尚未进入临床。
正大天晴与药明康德合作研发的TQB3804已进入I期临床阶段,是目前全球研 发进度最快的“第四代”EGFR-TKI。细胞实验中,该药对1/2/3代EGFR-TKI耐药后 出现的Del19/T790M/C797S、L858R/T790M/C797S、Del19/T790M、L858R/T790M 四种三重及二重突变都有比较好的抑制作用。在Del19/T790M/C797S的CDX肿瘤模 型中,TQB3804能够较好地延缓肿瘤的生长。如果临床进展顺利,我们预计该药可 能在2023年获批上市。
Bridge在研药物BBT-176临床申请已获得FDA批准。BBT-176在异种移植模 型中对三重突变Del19/T790M/C797S和L858R/T790M/C797S展现出了很强的抑制 作用,同时与抗EGFR抗体联合使用能够显著增强其抗肿瘤活性。
五、国内第三代 EGFR-TKI 销售峰值有望超过 170 亿
(一)非小细胞肺癌是我国第一大癌种
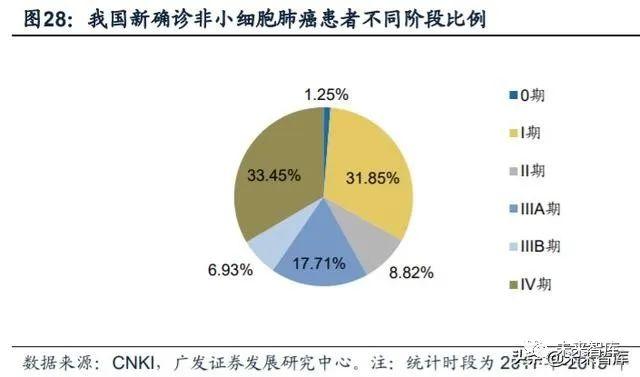
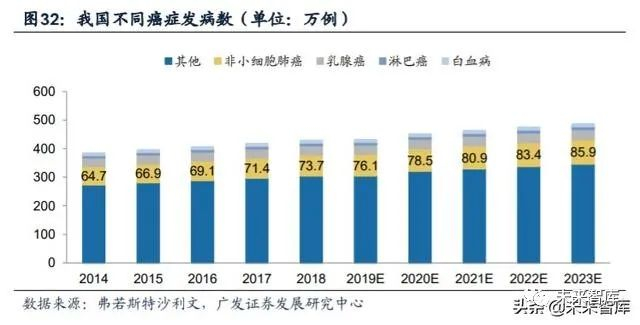
非小细胞肺癌是我国所有癌症类型中发病率最高的。癌症已经成为我国第一 大恶性疾病,肿瘤科疾病确诊病例总数由2014年的约380万例增加至约430万例。其 中非小细胞肺癌是所有癌症类型中发病率最高的,2018年国内肺癌新增86.8万例, 73.7万例为小细胞肺癌(约占85%),五年生存率仅为19.3%。从组织学分类来看, 非小细胞肺癌包含:腺瘤,非鳞状上皮癌,大细胞上皮癌,肉瘤样上皮癌以及腺鳞 状上皮癌等。早期的非小细胞肺癌主要依靠手术治疗,但约80%属于晚期不可切除 的非小细胞肺癌,只能以药物治疗为主。
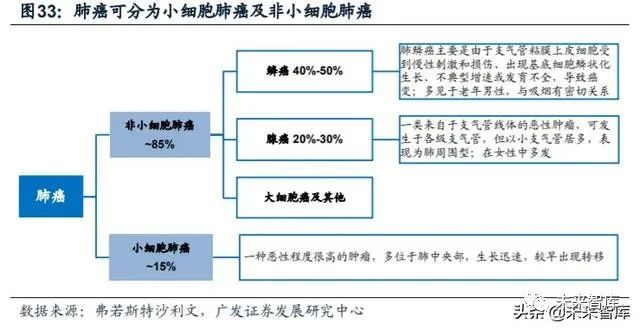
基于分子分型的方法,非小细胞肺癌可以被分为各种不同的分子亚型,并由 此诞生了各类分子靶向治疗药物。由于靶向药物相较于传统抗肿瘤药具有能够实现 个性化治疗、副作用小的特点,可以明显改善非小细胞肺癌患者的预后,靶向抗肿 瘤药在晚期非小细胞肺癌治疗中起着越来越重要的作用。
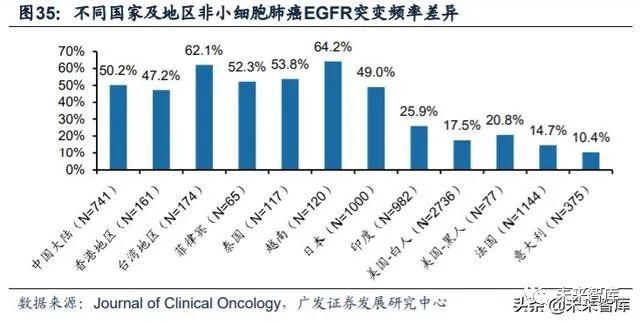
亚洲非小细胞肺癌患者EGFR突变频率显著高于其他人种,EGFR-TKI药物的 患者基数更加庞大。非小细胞肺癌患者中,不同类型基因突变的频率有着较大差异, 与欧美地区患者以KRAS突变(20%-30%)为主不同,亚洲患者以EGFR突变为主, 其中我国大陆地区突变频率约为50%,庞大的患者基数将造就三代EGFR-TKI药物广 阔的市场空间。
(二)一代 EGFR-TKI 对三代药物的启发:疗效、价格决定市场格局
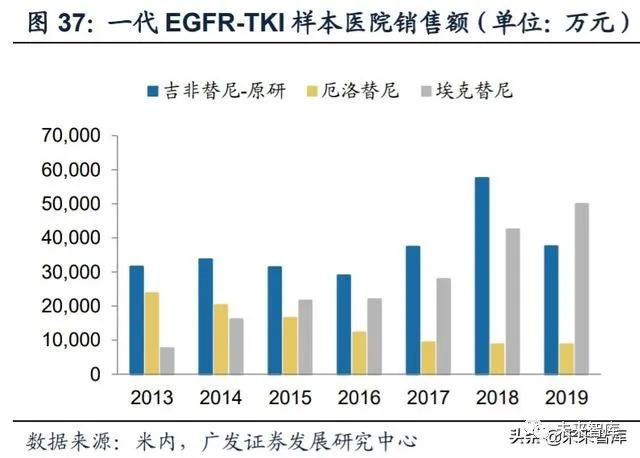
疗效、价格决定市场格局。国际市场上,由于厄洛替尼在上市初期便通过纳 入了713例患者的III期临床研究验证了疗效,同时吉非替尼受2005年FDA召回的影响 于2009年才重新上市,导致吉非替尼在全球市场的表现远不如厄洛替尼,全球峰值 销售额分别为6.47亿美元与14.45亿美元。但两种药物在中国市场的表现却与国际市 场大不相同。由于吉非替尼在国内比厄洛替尼早上市一年且价格更低,同时两者药 物在亚洲的临床数据差别不大,因此吉非替尼能够迅速抢占市场,销售表现一直优 于厄洛替尼,根据米内数据库,2019年国内样本医院销售额分别为3.75亿元(吉非 替尼原研)与0.87亿元(厄洛替尼)。国产新药埃克替尼上市后,凭借其优异的疗 效,同时价格比进口药物低25%左右,做到了迅速抢占国内市场份额。另外由于吉 非替尼因纳入“4+7带量采购”而大幅降价,2019年埃克替尼样本医院销售额首次 超过吉非替尼。
纳入医保助力产品渗透率快速提升,销量提升的影响远大于价格下降。2017 年新版医保目录中,三款第一代EGFR-TKI药物均被纳入,三者降价幅度分别为55%、 67%、54%,降价后患者月治疗费用相差不大,仅吉非替尼费用略高。纳入医保后 三种药物的整体销售额并未因大幅降价而下降,反而因加速放量而大幅上升。
根据我们的测算,目前国内市场一代EGFR-TKI药物的渗透率已经超过50%。我们对一代EGFR-TKI药物纳入医保前后的市场渗透率进行了测算,我们的测算主要 依据以下事实/假设:(1)由于阿斯利康和罗氏并未公布吉非替尼及厄洛替尼在国 内的销售额,我们依据埃克替尼在国内的销售额,基于样本医院竞争格局与整个市 场的竞争格局类似的前提,使用各药物样本医院的市场份额代替其整体市场份额, 可得到吉非替尼及厄洛替尼在国内的销售额估算值;(2)一代EGFR-TKI药物的疗 效类似,mPFS均为11个月左右,故每个患者的年治疗费用为月治疗费用乘11;(3) 进入医保之前,吉非替尼赠药政策为,对于非低保患者用药满5个月后赠药,厄洛替 尼为用药满4个月,埃克替尼为用药满6个月。贝达药业2018年年报披露,截至2018 年底埃克替尼累计已有近20万名患者用药,并向6万多名患者赠药。贝达药业2019 年报披露,截至2020年一季度,埃克替尼已有20多万名患者用药,向超过8万名的 患者赠药。因此,根据埃克替尼的赠药比例,我们假设全部一代TKI用药患者中有30% 的患者能够获得赠药。吉非替尼与厄洛替尼在进入医保后终止赠药项目,埃克替尼 在进入医保后仍然继续赠药。根据我们的测算结果,2017年纳入医保后,一代TKI 药物的市场渗透率达到28.6%;2019年吉非替尼因纳入“4+7带量采购”大幅降价 后,一代TKI药物整体渗透率达到57.1%。
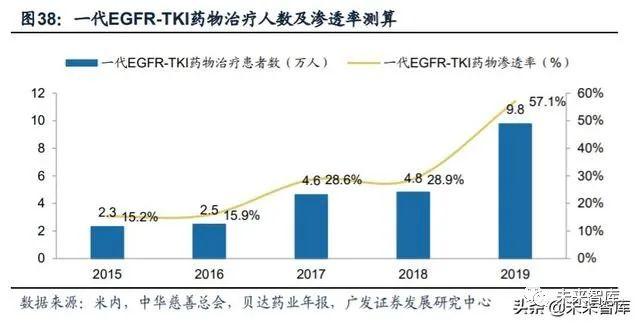
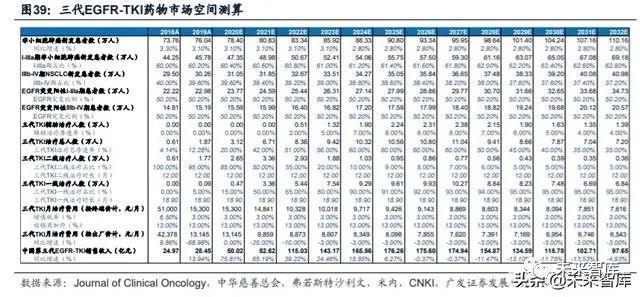
(三)国内第三代 EGFR-TKI 药物市场空间测算
我们预计三代EGFR-TKI药物的市场规模将在2025年达到峰值176亿元。我们 的测算主要基于以下几点假设/依据:(1)根据弗若斯特沙利文,2018年我国新发 非小细胞肺癌73.76万人,2019年-2023年新发患者数增速为3.1%,2024年后为2.8%;(2)根据邹继霞等人的研究,2011年-2015年间我国新确诊的非小细胞肺癌患者中, IIIb及IV期的占比为40.4%,预计随着癌症检测的普及,更多的患者将在更早期阶段 确诊,预计该比例将每年下降0.2%;(3)根据《Journal of Clinical Oncology》, 我国非小细胞肺癌患者中,EGFR突变阳性的比例为50.2%;(4)根据弗若斯特沙 利文,2018年奥希替尼在国内的销售额为24.97亿元。由于阿斯利康没有披露2019 年奥希替尼在中国的销售额,我们以样本医院销售额乘以放大因子3作为国内销售额;(5)2018年,奥希替尼在未进入医保时采取的赠药政策为买4赠8,但满足条件不 一定获赠,我们假设有30%的病人满足条件并获得赠药;(6)奥希替尼在国内于2019 年9月获批一线治疗,2019年用于一线治疗药物的销售时间为4个月;(7)预计奥 希替尼将在2020年作为一线用药进入医保,并进一步降价25%,降价将在2021年执 行;(8)2021年国产药物进入医保后,预计价格为奥希替尼的80%,将带动三代 TKI药物整体价格在2022年下降10%。三代TKI药物在经过两次医保降价后,预计后 续不会再发生进一步的大幅降价。
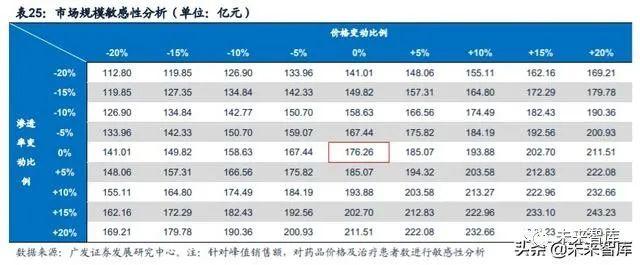
六、重点公司(详见报告原文)
(一)翰森制药:创新驱动的制药龙头,管线布局全面丰富
(二)艾力斯:专注非小细胞肺癌小分子靶向药,重磅艾氟替尼即将上市
(三)贝达药业:深耕肿瘤治疗领域,国内稀缺的创新药企业
(四)奥赛康:国内质子泵抑制剂注射剂龙头,抗肿瘤、抗耐药菌感染、 糖尿病均有丰富布局
……
(报告观点属于原作者,仅供参考。报告来源:广发证券)
获取报告请登录未来智库www.vzkoo.com。


